Acompañamiento Virtual a Estudiantes - Química
General

- IMPORTANTEPara comunicarse con las profesoras envíe un MENSAJEpresionando en el sobrecito que está a la derecha del nombre.
- Química: Ciencia de la materia y sus transformaciones

- La materia y sus propiedades

- Sistemas materiales: mezclas y cuerpos puros

- Mezclas heterogéneas: separación de fases

- Mezclas homogéneas: métodos de fraccionamiento

- Soluciones

- Solubilidad

- Concentración de soluciones

- Las sustancias y sus propiedades

- Sustancias y Elementos

- Monóxido de carbono

- Cambios físicos y químicos

- Reacciones químicas

- "El jabón de la abuela" Pictogramas de protección

- Estructura de la materia

- Reacciones químicas a nivel molecular

- Átomo

- Núcleo atómico. Radiactividad

- Fisión nuclear. Centrales nucleares

- Periferia atómica

- Tabla Periódica de los elementos químicos

- Metales y No Metales

- No Metal-Hidrógeno

- Bioelementos

- Estabilidad química

- Enlace químico

- Enlace covalente polar y no polar

- Óxidos. Introducción

- Formulación de óxidos

- Nomenclatura de óxidos

- El convertidor catalítico

- Ácidos y Bases

- Sección 33
- Sección 34
- Sección 35
- Sección 36
- Sección 38
- Sección 40
- Sección 41
- Sección 42
- Sección 43
- Sección 44
- Sección 45
- Sección 46
- Sección 47
- Sección 48
- Sección 49
- Sección 50
- Sección 51
- Sección 52
Química: Ciencia de la materia y sus transformaciones

QUÍMICA: CIENCIA DE LA MATERIA Y SUS TRANSFORMACIONES
 “La química desempeña un papel fundamental, tanto por el puesto que ocupa en las ciencias de la naturaleza y del conocimiento como por su importancia económica y su omnipresencia en nuestra vida diaria… La química contribuye de forma decisiva a satisfacer las necesidades de la humanidad en alimentación, medicamentos, indumentaria, vivienda, energía, materias primas, transportes y comunicaciones…Un mundo sin química estaría desprovisto de materiales sintéticos y, por lo tanto, carecería de teléfonos, ordenadores, tejidos sintéticos y cines. Sería también un mundo carente, entre otras muchas cosas, de aspirinas, jabones, champús, dentífricos, cosméticos, píldoras anticonceptivas, colas, pinturas y papel, por lo que no habría tampoco ni periódicos ni libros.No olvidemos que la química ayuda a los historiadores del arte a descubrir algunos de los secretos de fabricación de los cuadros y esculturas que admiramos en los museos. Recordemos asimismo que permite a la policía científica analizar las muestras recogidas en el “escenario del delito” e identificar así a los culpables más rápidamente, y por último sepamos también que es ella la que descubre las sutilezas moleculares de los platos que cautivan nuestro paladar.Junto con la física, que descifra las leyes del universo, y la biología, que descodifica las reglas de la vida, la química es la ciencia de la materia y de sus transformaciones.”Extraído y adaptado del artículo “La química: ciencia y arte de la materia”.El Corrreo de la UNESCO. Enero-marzo de 2011Pero además, por si fuera poco, la mejora de la calidad de vida y el aumento de la expectativa de vida se debe en gran medida a las investigaciones y los conocimientos aportados por la Química. Dos de los aportes fundamentales de la Química que más contribuyeron en este sentido son la potabilización del agua y el desarrollo de los antibióticos.Desde que nos levantamos hasta que nos acostamos nos relacionamos con la Química
“La química desempeña un papel fundamental, tanto por el puesto que ocupa en las ciencias de la naturaleza y del conocimiento como por su importancia económica y su omnipresencia en nuestra vida diaria… La química contribuye de forma decisiva a satisfacer las necesidades de la humanidad en alimentación, medicamentos, indumentaria, vivienda, energía, materias primas, transportes y comunicaciones…Un mundo sin química estaría desprovisto de materiales sintéticos y, por lo tanto, carecería de teléfonos, ordenadores, tejidos sintéticos y cines. Sería también un mundo carente, entre otras muchas cosas, de aspirinas, jabones, champús, dentífricos, cosméticos, píldoras anticonceptivas, colas, pinturas y papel, por lo que no habría tampoco ni periódicos ni libros.No olvidemos que la química ayuda a los historiadores del arte a descubrir algunos de los secretos de fabricación de los cuadros y esculturas que admiramos en los museos. Recordemos asimismo que permite a la policía científica analizar las muestras recogidas en el “escenario del delito” e identificar así a los culpables más rápidamente, y por último sepamos también que es ella la que descubre las sutilezas moleculares de los platos que cautivan nuestro paladar.Junto con la física, que descifra las leyes del universo, y la biología, que descodifica las reglas de la vida, la química es la ciencia de la materia y de sus transformaciones.”Extraído y adaptado del artículo “La química: ciencia y arte de la materia”.El Corrreo de la UNESCO. Enero-marzo de 2011Pero además, por si fuera poco, la mejora de la calidad de vida y el aumento de la expectativa de vida se debe en gran medida a las investigaciones y los conocimientos aportados por la Química. Dos de los aportes fundamentales de la Química que más contribuyeron en este sentido son la potabilización del agua y el desarrollo de los antibióticos.Desde que nos levantamos hasta que nos acostamos nos relacionamos con la Química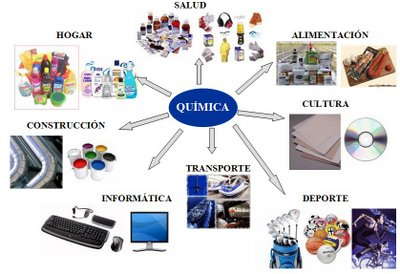
La materia y sus propiedades

LA MATERIA Y SUS PROPIEDADES
¿A QUÉ SE DENOMINA MATERIA?Dado que la Química es la ciencia que estudia la materia y sus transformaciones, comenzaremos por plantearnos qué es aquello a lo que se da el nombre de materia.Aunque parezca sencillo, en realidad no es fácil definir materia. No basta con decir solamente que la materia es aquello que se puede percibir con los sentidos; la luz es perceptible y no es materia sino energía.La masa es una propiedad fundamental de la materia, pero esta propiedad tampoco parece ser propia de la materia, dado que la luz puede doblarse por la influencia gravitacional de una estrella como si tuviera masa.Dado lo complejo que resulta definir materia, lo que haremos es describir sus propiedades y aventurarnos en el estudio de su estructura.En general, independientemente de su definición, para nadie resultará difícil reconocer la materia. Si es perceptible, tangible, palpable, sin duda es materia.La materia tiene volumen, masa, peso y otras propiedades tales como temperatura y densidad, por mencionar sólo aquellas propiedades que han sido estudiadas en cursos anteriores.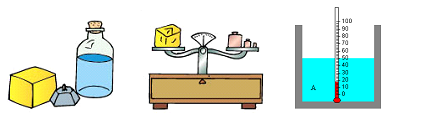 La materia se presenta en diferentes estados, siendo los 3 fundamentales, el estado sólido, el estado líquido y el estado gaseoso.
La materia se presenta en diferentes estados, siendo los 3 fundamentales, el estado sólido, el estado líquido y el estado gaseoso.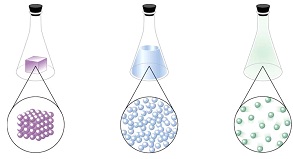 La materia experimenta cambios permanentemente, seamos o no conscientes de ello. Estos cambios pueden ser físicos o químicos y serán estudiados más adelante en el curso.
La materia experimenta cambios permanentemente, seamos o no conscientes de ello. Estos cambios pueden ser físicos o químicos y serán estudiados más adelante en el curso.
Sistemas materiales: mezclas y cuerpos puros

SISTEMAS MATERIALES: MEZCLAS Y CUERPOS PUROS
Un sistema es una porción del universo material que se delimita para su estudio.Es necesario especificar claramente cuáles son los límites del sistema, es decir, que es lo que forma parte del sistema y que es lo que forma parte del entorno o ambiente. A modo de ejemplo, consideremos el sistema que se muestra en la imagen: La mayor parte de los sistemas materiales son mezclas de 2 o más tipos de sustancias.También hay sistemas constituidos por un sola sola clase de sustancias, los cuales reciben el nombre de cuerpos puros.En la naturaleza prácticamente no se encuentran cuerpos puros, la materia se presenta en forma de complejas mezclas. Ejemplos de materiales que pueden encontrarse como cuerpos puros en la naturaleza son el diamante, el oro y el azufre.Es importante tener presente que en una mezcla las sustancias no cambian, es decir conservan sus propiedades características.Las mezclas se clasifican, según el número de fases en homogéneas y heterogéneas. Las mezclas homogéneas son aquellas que tienen una sola fase y las heterogéneas son las que tienen 2 o más fases.
La mayor parte de los sistemas materiales son mezclas de 2 o más tipos de sustancias.También hay sistemas constituidos por un sola sola clase de sustancias, los cuales reciben el nombre de cuerpos puros.En la naturaleza prácticamente no se encuentran cuerpos puros, la materia se presenta en forma de complejas mezclas. Ejemplos de materiales que pueden encontrarse como cuerpos puros en la naturaleza son el diamante, el oro y el azufre.Es importante tener presente que en una mezcla las sustancias no cambian, es decir conservan sus propiedades características.Las mezclas se clasifican, según el número de fases en homogéneas y heterogéneas. Las mezclas homogéneas son aquellas que tienen una sola fase y las heterogéneas son las que tienen 2 o más fases. PROFUNDIZANDO EN EL ESTUDIO DE LOS MEZCLAS HETEROGÉNEAS…Además de las mezclas heterogéneas macroscópicas cuyas fases son visibles a simple vista, existen otras como las suspensiones y las dispersiones coloidales cuyas fases no se distinguen a simple vista.
PROFUNDIZANDO EN EL ESTUDIO DE LOS MEZCLAS HETEROGÉNEAS…Además de las mezclas heterogéneas macroscópicas cuyas fases son visibles a simple vista, existen otras como las suspensiones y las dispersiones coloidales cuyas fases no se distinguen a simple vista.Las suspensiones están formadas por una fase sólida (finamente dividida), dispersa en una fase líquida. Es el caso de las pinturas y muchos preparados farmacéuticos. Generalmente presentan un aspecto turbio. Cuando estas mezclas son inestables, al dejarlas en reposo, las fases se separan (por lo que pueden visualizarse) quedando la fase sólida depositada en el fondo (se dice que sedimenta). El tamaño de la fase sólida (fase dispersa) es mayor a 0,1µ (1x10-7m).
Las dispersiones coloidales o coloides son mezclas formadas por 2 o más fases, una continua (fase dispersante) que puede ser líquida, sólida o gaseosa y una fase dispersa que puede ser sólida, líquida o gaseosa. Se requiere de un ultramicroscopio para visualizar las fases pues la fase dispersa tiene un tamaño muy pequeño, menor a 0,1µ.
El ultramicroscopio es un microscopio óptico que tiene un sistema de iluminación lateral, diferente al microscopio óptico convencional, que hace posible visualizar porciones de materia menores a 0,1 μ (1 μ = 1x10-6 m = 1x10-4 cm= 1x10-3mm).

Mezclas heterogéneas: separación de fases

MEZCLAS HETEROGÉNEAS: SEPARACIÓN DE FASES
En la industria, en laboratorios de análisis clínicos donde se realizan diferentes estudios a partir de la sangre y la orina así como en la vida cotidiana, es necesario separar las fases de diferentes mezclas heterogéneas.Para ello se recurre a los métodos de separación de fases que consisten en procedimientos mecánicos que se aplican a las mezclas heterogéneas con la finalidad de separar las distintas fases.Algunos de los principales métodos de separación de fases se mencionan a continuación:
Mezclas homogéneas: métodos de fraccionamiento

MEZCLAS HOMOGÉNEAS. MÉTODOS DE FRACCIONAMIENTO
Las mezclas homogéneas presentan idénticas propiedades intensivas en todos sus puntos, es decir tienen una sola fase.Muchas mezclas que a simple vista parecen homogéneas no lo son. Aunque presentan un aspecto uniforme al ser observadas a simple vista o con un microscopio óptico, cuando son observadas con un ultramicroscopio se visualizan porciones de materia con distintas propiedades intensivas. Estas porciones de materia se hallan “finamente divididas” teniendo un tamaño menor a 0,1μ (1 μ equivale a 1x10-3mm).Cuando se tiene una mezcla en la que las porciones de materia tienen un tamaño tan pequeño que no pueden ser visibles con un ultramicroscopio, la mezcla se clasifica como homogénea.Por ejemplo, las bebidas alcohólicas son mezclas homogéneas de varios componentes (sustancias). Si se quiere separar el alcohol presente en ellas, ninguno de los métodos estudiados serán de utilidad dado que son métodos de separación de fases, y en este caso la mezcla presenta una sola fase.Para separar los componentes (sustancias) de una mezcla homogénea hay que aplicar otros métodos conocidos como métodos de fraccionamiento. Dependiendo de las propiedades de las sustancias que componen la mezcla y del método utilizado, se podrán separar y obtener los componentes con distinto grado de pureza.Los métodos de fraccionamiento son los siguientes:• Destilación simple y fraccionada• Cristalización• Cromatografía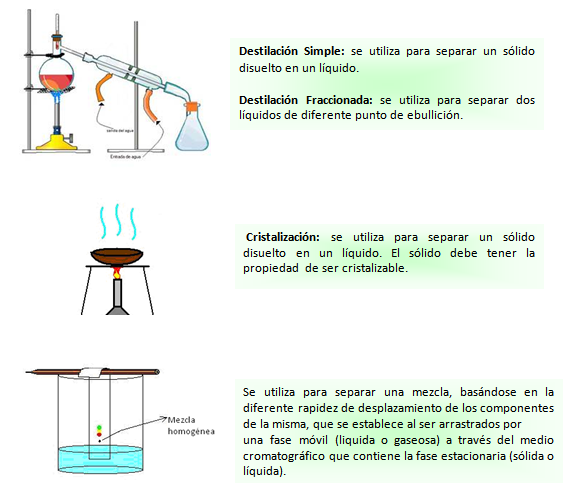
Soluciones

SOLUCIONES
Si se filtra el agua de mar se logra separar los sólidos en suspensión como arena, algas, etc. Sin embargo, las sales presentes en ella que le dan el característico sabor salado no quedarán retenidas en el filtro ni tampoco se separarán con una centrifugación a altas velocidades. Lo que sucede es que las sales se hallan disueltas en el agua de mar formando una sola fase. Las sustancias que constituyen una solución reciben el nombre de soluto y solvente.• Solvente: componente que se encuentra en mayor proporción. Es el componente que disuelve y determina el estado físico de la solución. O sea que, si el soluto está en estado sólido y el solvente en estado líquido, la solución resultará líquida.• Soluto: componente que se encuentra en menor proporción. Es el que se disuelve en el solvente.A nivel de partículas, una solución constituida por un soluto y un solvente, como por ejemplo azúcar disuelta en agua puede representarse del siguiente modo:
Las sustancias que constituyen una solución reciben el nombre de soluto y solvente.• Solvente: componente que se encuentra en mayor proporción. Es el componente que disuelve y determina el estado físico de la solución. O sea que, si el soluto está en estado sólido y el solvente en estado líquido, la solución resultará líquida.• Soluto: componente que se encuentra en menor proporción. Es el que se disuelve en el solvente.A nivel de partículas, una solución constituida por un soluto y un solvente, como por ejemplo azúcar disuelta en agua puede representarse del siguiente modo: En el caso del agua azucarada se puede decir que es una solución acuosa, lo que significa que el solvente es agua. Como el agua es la sustancia que más solutos disuelve, es cotidiano en química decir “solución acuosa”.
En el caso del agua azucarada se puede decir que es una solución acuosa, lo que significa que el solvente es agua. Como el agua es la sustancia que más solutos disuelve, es cotidiano en química decir “solución acuosa”.
Solubilidad

SOLUBILIDAD
Muchas de las acciones cotidianas como por ejemplo la que realiza un mecánico al limpiarse la grasa de las manos con aguarrás u otro solvente similar o una persona que se quita el esmalte de las uñas con acetona, están relacionadas con la solubilidad, es decir, con la capacidad de cierto soluto de disolverse en determinado solvente. El azúcar y la sal son solubles en agua, las grasas lo son en disán, aguarras o queroseno, pero, ¿qué tan soluble son estos solutos en estos solventes?Para conocer el “límite” de solubilidad de un soluto en un solvente determinado es necesario conocer cuál es el valor de la solubilidad, a lo que se da el nombre de coeficiente de solubilidad. Para hallarlo se toma 100mL de solvente y se determina la masa de soluto que se disuelve cómo máximo en dicho volumen. Siempre se debe aclarar a qué temperatura se determinó el valor.
El azúcar y la sal son solubles en agua, las grasas lo son en disán, aguarras o queroseno, pero, ¿qué tan soluble son estos solutos en estos solventes?Para conocer el “límite” de solubilidad de un soluto en un solvente determinado es necesario conocer cuál es el valor de la solubilidad, a lo que se da el nombre de coeficiente de solubilidad. Para hallarlo se toma 100mL de solvente y se determina la masa de soluto que se disuelve cómo máximo en dicho volumen. Siempre se debe aclarar a qué temperatura se determinó el valor. Una solución que contiene disuelta la máxima cantidad de soluto que puede disolverse en determinada cantidad de solvente a una cierta temperatura, se dice que está saturada.Analicemos un ejemplo:
Una solución que contiene disuelta la máxima cantidad de soluto que puede disolverse en determinada cantidad de solvente a una cierta temperatura, se dice que está saturada.Analicemos un ejemplo: Se sabe que el coeficiente de solubilidad del cloruro de sodio (sal de mesa) a 20°C es 36,0g en 100mL de agua.¿Cómo se puede verificar dicho dato?Se colocan 100mL de agua a 20°C en un recipiente. Y por otro lado se miden 36,0g de sal con una balanza.Se coloca la sal en el recipiente y se revuelve con una cuchara hasta que se disuelva totalmente. Así se obtiene una solución acuosa saturada de sal.Si se trata de disolver un poco más de sal, no se disolverá y quedará depositada en el fondo del recipiente.
Se sabe que el coeficiente de solubilidad del cloruro de sodio (sal de mesa) a 20°C es 36,0g en 100mL de agua.¿Cómo se puede verificar dicho dato?Se colocan 100mL de agua a 20°C en un recipiente. Y por otro lado se miden 36,0g de sal con una balanza.Se coloca la sal en el recipiente y se revuelve con una cuchara hasta que se disuelva totalmente. Así se obtiene una solución acuosa saturada de sal.Si se trata de disolver un poco más de sal, no se disolverá y quedará depositada en el fondo del recipiente.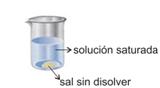
Concentración de soluciones

CONCENTRACIÓN DE SOLUCIONES
 Una forma de clasificar las soluciones es teniendo en cuenta la relación entre la cantidad de soluto y la cantidad de solvente. Es así que se pueden clasificar en diluidas y concentradas.• Soluciones diluidas: son aquellas en las que la cantidad de soluto es muy pequeña comparada con la de solvente.• Soluciones concentradas: son aquellas en las que la cantidad de soluto es considerablemente grande en comparación con la cantidad de solvente.
Una forma de clasificar las soluciones es teniendo en cuenta la relación entre la cantidad de soluto y la cantidad de solvente. Es así que se pueden clasificar en diluidas y concentradas.• Soluciones diluidas: son aquellas en las que la cantidad de soluto es muy pequeña comparada con la de solvente.• Soluciones concentradas: son aquellas en las que la cantidad de soluto es considerablemente grande en comparación con la cantidad de solvente.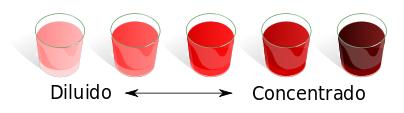 Los términos concentrada y diluida sirven para describir cualitativamente una solución pero si se desea conocer con exactitud la concentración de una solución, es decir la cantidad de soluto en relación a la cantidad de solvente se deben utilizar formas de expresar la concentración.Existen diferentes formas de expresar la concentración de una solución, algunas de ellas son:• % V/V ( Relación porcentual entre volumen de soluto y volumen de solución)• %m/m (Relación porcentual entre masa de soluto y masa de solución)• g/L (Relación entre la masa de soluto en gramos y el volumen de solución en litros)
Los términos concentrada y diluida sirven para describir cualitativamente una solución pero si se desea conocer con exactitud la concentración de una solución, es decir la cantidad de soluto en relación a la cantidad de solvente se deben utilizar formas de expresar la concentración.Existen diferentes formas de expresar la concentración de una solución, algunas de ellas son:• % V/V ( Relación porcentual entre volumen de soluto y volumen de solución)• %m/m (Relación porcentual entre masa de soluto y masa de solución)• g/L (Relación entre la masa de soluto en gramos y el volumen de solución en litros)
Las sustancias y sus propiedades

LAS SUSTANCIAS Y SUS PROPIEDADES
¿CÓMO SE PUEDEN IDENTIFICAR LAS SUSTANCIAS?Las imágenes muestran 3 sustancias distintas pero de aspecto físico muy similar.Es común que en los laboratorios se pierdan o se estropeen las etiquetas de los frascos que contienen las sustancias.¿Cómo se podrían identificar las sustancias si sucediera esto? Hay propiedades características que se pueden medir y otras que no. Aquellas propiedades características que se pueden medir y tienen un valor fijo para cada sustancia se denominan constantes físicas.Las constantes físicas son de gran utilidad ya que sus valores son confiables no solo para identificar una sustancia sino también para determinar su grado de pureza.Para identificar una sustancia no alcanza con conocer una de sus propiedades características, sino que se debe conocer el valor de varias de ellas, siendo las más importantes y fáciles de determinar:• Densidad: relación entre la masa y el volumen.• Temperatura de fusión: temperatura constante a la cual una sustancia funde.• Temperatura de ebullición: temperatura constante a la cual una sustancia hierve.• Solubilidad: capacidad de una sustancia de disolverse en otra.¿CÓMO SE PUEDE SABER SI UNA SUSTANCIA ES PURA O CONTIENE IMPUREZAS?Es muy difícil obtener sustancias puras, razón por la cual prácticamente todas las sustancias de uso común en el laboratorio tienen cierta cantidad de impurezas mezcladas. El grado de pureza de una sustancia puede variar, por ejemplo el NaOH comercial (soda cáustica) tiene un % de pureza del 78%, pero existen otras sustancias de uso medicinal o empleadas en investigaciones cuyo grado de pureza es del 99%, 99,9%, 99,99% o 99,999%.Se puede determinar experimentalmente si una sustancia es pura o si contiene impurezas. A modo de ejemplo se muestran 2 curvas de enfriamiento: la primera que corresponde a una sustancia pura y la segunda que corresponde a una sustancia con impurezas, es decir a una mezcla de sustancias.
Hay propiedades características que se pueden medir y otras que no. Aquellas propiedades características que se pueden medir y tienen un valor fijo para cada sustancia se denominan constantes físicas.Las constantes físicas son de gran utilidad ya que sus valores son confiables no solo para identificar una sustancia sino también para determinar su grado de pureza.Para identificar una sustancia no alcanza con conocer una de sus propiedades características, sino que se debe conocer el valor de varias de ellas, siendo las más importantes y fáciles de determinar:• Densidad: relación entre la masa y el volumen.• Temperatura de fusión: temperatura constante a la cual una sustancia funde.• Temperatura de ebullición: temperatura constante a la cual una sustancia hierve.• Solubilidad: capacidad de una sustancia de disolverse en otra.¿CÓMO SE PUEDE SABER SI UNA SUSTANCIA ES PURA O CONTIENE IMPUREZAS?Es muy difícil obtener sustancias puras, razón por la cual prácticamente todas las sustancias de uso común en el laboratorio tienen cierta cantidad de impurezas mezcladas. El grado de pureza de una sustancia puede variar, por ejemplo el NaOH comercial (soda cáustica) tiene un % de pureza del 78%, pero existen otras sustancias de uso medicinal o empleadas en investigaciones cuyo grado de pureza es del 99%, 99,9%, 99,99% o 99,999%.Se puede determinar experimentalmente si una sustancia es pura o si contiene impurezas. A modo de ejemplo se muestran 2 curvas de enfriamiento: la primera que corresponde a una sustancia pura y la segunda que corresponde a una sustancia con impurezas, es decir a una mezcla de sustancias.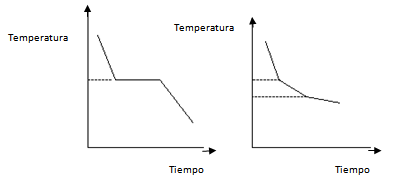
Sustancias y Elementos

SUSTANCIAS Y ELEMENTOS
Todas las sustancias están constituidas por elementos químicos.En principio y de forma sencilla se puede definir elemento químico de la siguiente manera: Las sustancias se representan mediante fórmulas y los elementos mediante símbolos químicos.Los símbolos químicos consisten en 1 letra mayúscula o 2 letras (mayúscula la 1º y minúscula la 2º) las cuales son universales y derivan del nombre del elemento en latín, griego, etc.En las fórmulas aparecen los símbolos de los elementos que componen la sustancia además de números cuyo significado será estudiado más adelante.Analicemos los siguientes ejemplos:
Las sustancias se representan mediante fórmulas y los elementos mediante símbolos químicos.Los símbolos químicos consisten en 1 letra mayúscula o 2 letras (mayúscula la 1º y minúscula la 2º) las cuales son universales y derivan del nombre del elemento en latín, griego, etc.En las fórmulas aparecen los símbolos de los elementos que componen la sustancia además de números cuyo significado será estudiado más adelante.Analicemos los siguientes ejemplos: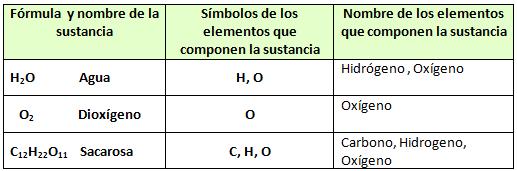 Las sustancias como el agua (H2O) y la sacarosa (C12H22O11) constituidas por 2 o más elementos químicos diferentes se denominan sustancias compuestas y las sustancias como el O2 constituida por una sola clase de elemento químico se denominan sustancias simples.
Las sustancias como el agua (H2O) y la sacarosa (C12H22O11) constituidas por 2 o más elementos químicos diferentes se denominan sustancias compuestas y las sustancias como el O2 constituida por una sola clase de elemento químico se denominan sustancias simples.
Monóxido de carbono

MONÓXIDO DE CARBONO
“La concentración de CO en el tránsito citadino con frecuencia alcanza 50 ppm y puede aumentar hasta 140 ppm durante los embotellamientos. La fuente de envenenamiento más seria con CO es, sin embargo, la que proviene de fumar cigarrillos. El humo de cigarro que se inhala contiene alrededor de 400 ppm de CO. El CO, comúnmente conocido como monóxido de carbono, es un gas invisible, inodoro e insípido; ejerce su efecto insidioso inutilizando la hemoglobina de la sangre. La función normal de la hemoglobina es transportar dioxígeno. El CO se une a la hemoglobina con tal fuerza que le impide transportar dioxígeno.Por ello, los síntomas de envenenamiento con CO son los de privación del dioxígeno. El mejor antídoto es la administración de dioxígeno puro. La respiración artificial puede ayudar si no se cuenta con tanque de dioxígeno.”Material extraído: Chang Raymond, “Química General” y Brown, Theodore, “Química: La Ciencia Central”.
El CO, comúnmente conocido como monóxido de carbono, es un gas invisible, inodoro e insípido; ejerce su efecto insidioso inutilizando la hemoglobina de la sangre. La función normal de la hemoglobina es transportar dioxígeno. El CO se une a la hemoglobina con tal fuerza que le impide transportar dioxígeno.Por ello, los síntomas de envenenamiento con CO son los de privación del dioxígeno. El mejor antídoto es la administración de dioxígeno puro. La respiración artificial puede ayudar si no se cuenta con tanque de dioxígeno.”Material extraído: Chang Raymond, “Química General” y Brown, Theodore, “Química: La Ciencia Central”.
Cambios físicos y químicos

CAMBIOS FÍSICOS Y QUÍMICOS
En la materia están ocurriendo cambios continuamente seamos o no conscientes de ellos. Cuando respiramos, cuando las hojas de los árboles cambian de color, al cocinar, al quemar un trozo de papel o encender el motor de un automóvil, las sustancias experimentan diferentes cambios. Estos cambios pueden ser físicos o químicos.Cambio físico: transformación de la materia sin que se modifique la composición química de las sustancias que la componen. Las sustancias son las mismas antes y después de la transformación.Por ejemplo, cuando los materiales cambian de forma, se cortan o se estiran las sustancias que los componen no se transforman en otras, son las mismas antes y después.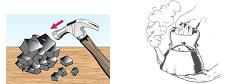 Cambio químico: transformación de la materia en la que las sustancias que la componen se transforman en otras sustancias diferentes. En este caso las sustancias cambian su composición química.Por ejemplo, cuando se oxida el hierro, cuando se quema un combustible, cuando se prepara caramelo para un postre o se cocina un huevo.
Cambio químico: transformación de la materia en la que las sustancias que la componen se transforman en otras sustancias diferentes. En este caso las sustancias cambian su composición química.Por ejemplo, cuando se oxida el hierro, cuando se quema un combustible, cuando se prepara caramelo para un postre o se cocina un huevo.
Reacciones químicas

REACCIONES QUÍMICAS
Muchos de los cambios que se observan a diario son cambios químicos que se producen porque las sustancias experimentan reacciones químicas.Cuando se quema madera o se oxida un clavo de hierro tienen lugar reacciones químicas pues se forman nuevas sustancias. Una reacción química es la transformación de una o más sustancias llamadas reactivos en otras sustancias diferentes llamadas productos.Existen distintos tipos de reacciones químicas; algunas de ellas son las siguientes:
Una reacción química es la transformación de una o más sustancias llamadas reactivos en otras sustancias diferentes llamadas productos.Existen distintos tipos de reacciones químicas; algunas de ellas son las siguientes:1. Reacciones de descomposición: a partir de una sustancia se obtienen 2 o más sustancias diferentes.
2. Reacciones de combinación: a partir de 2 o más sustancias se obtiene una nueva sustancia.
3. Reacciones de combustión: una sustancia llamada combustible reacciona con O2 (comburente) liberándose energía en forma de luz y calor.
En ocasiones no es fácil detectar el transcurso de una reacción química. Sin embargo, algunas manifestaciones nos pueden ayudar a reconocer cuando está teniendo lugar o ha tenido lugar una reacción química.Toda reacción química se representa mediante una expresión simbólica que recibe el nombre de ecuación química.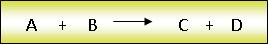 Por convención, las fórmulas de los reactivos se escriben a la izquierda y las de los productos a la derecha separadas con una flecha.
Por convención, las fórmulas de los reactivos se escriben a la izquierda y las de los productos a la derecha separadas con una flecha.
"El jabón de la abuela" Pictogramas de protección

" EL JABÓN DE LA ABUELA" Pictogramas de protección.
La RecetaMateriales y Sustancias:- 1L de agua (H2O)

- 400g de soda cáustica (NaOH)
- 3 L de aceite comestible usado
- Recipiente de plástico o vidrio resistente al calor.
- Cuchara de madera.
- Guantes de goma.
- Gafas de seguridad
Nota: Se debe tener en cuenta al considerar la masa de NaOH, que la soda cáustica comercial tiene una pureza del 70%.
 SODA CAÚSTICA: http://www.ercoworldwide.com/index.php/products/caustic/?lang=esProcedimiento:1. Coloca agua en un recipiente de plástico y agrega la soda cáustica poco a poco, revolviendo con una cuchara de madera hasta que se disuelva completamente. Ten cuidado pues durante el proceso de disolución, la temperatura aumenta. También se debe evitar las salpicaduras sobre cualquier parte del cuerpo porque el NaOH es una sustancia corrosiva.2. Deja enfriar hasta aproximadamente 35ºC y luego se agrega el aceite poco a poco revolviendo sin parar hasta que se espese (consistencia similar a la miel). Cuando se ha logrado esta consistencia, se puede agregar si se desea alguna esencia para perfumar.3. Coloca el preparado en un recipiente de plástico, deja reposar algunas horas, cuando haya endurecido un poco y haya eliminado el agua, se puede cortar en forma de pastillas.4. Deja reposar en un lugar seco durante 2 semanas antes de utilizarlo.PictogramasAlgunas sustancias pueden presentar efectos adversos para los seres humanos o el medio ambiente. Por esta razón, cierto número de países y organizaciones han desarrollado a lo largo de los años leyes o reglamentos que requieren la transmisión de la información necesaria mediante etiquetas o fichas de datos de seguridad a los usuarios.El Sistema Globalmente Armonizado de Clasificación y Etiquetado de Productos Químicos (SGA) es un sistema de comunicación de riesgos.
SODA CAÚSTICA: http://www.ercoworldwide.com/index.php/products/caustic/?lang=esProcedimiento:1. Coloca agua en un recipiente de plástico y agrega la soda cáustica poco a poco, revolviendo con una cuchara de madera hasta que se disuelva completamente. Ten cuidado pues durante el proceso de disolución, la temperatura aumenta. También se debe evitar las salpicaduras sobre cualquier parte del cuerpo porque el NaOH es una sustancia corrosiva.2. Deja enfriar hasta aproximadamente 35ºC y luego se agrega el aceite poco a poco revolviendo sin parar hasta que se espese (consistencia similar a la miel). Cuando se ha logrado esta consistencia, se puede agregar si se desea alguna esencia para perfumar.3. Coloca el preparado en un recipiente de plástico, deja reposar algunas horas, cuando haya endurecido un poco y haya eliminado el agua, se puede cortar en forma de pastillas.4. Deja reposar en un lugar seco durante 2 semanas antes de utilizarlo.PictogramasAlgunas sustancias pueden presentar efectos adversos para los seres humanos o el medio ambiente. Por esta razón, cierto número de países y organizaciones han desarrollado a lo largo de los años leyes o reglamentos que requieren la transmisión de la información necesaria mediante etiquetas o fichas de datos de seguridad a los usuarios.El Sistema Globalmente Armonizado de Clasificación y Etiquetado de Productos Químicos (SGA) es un sistema de comunicación de riesgos.
- 1L de agua (H2O)
Estructura de la materia

ESTRUCTURA DE LA MATERIA
Todas las sustancias que se encuentran formando parte de la materia conocida, están constituidas por partículas. Entre ellas sólo hay vacío, por eso se dice que materia es discontinua.Las partículas que componen las sustancias son átomos o agrupaciones de 2 o más átomos denominadas moléculas. Existe otro tipo de partículas llamadas iones que poseen carga eléctrica cuyo estudio no será abordado en esta etapa. Muchas sustancias conocidas como el agua, el azúcar, el dióxido de carbono y el dioxígeno, están constituidas por moléculas.A modo de ejemplo consideremos la sustancia agua:Cuando se representa la sustancia agua mediante la fórmula H2O, lo que se está representando es la molécula de agua, por eso se llama fórmula molecular.
Muchas sustancias conocidas como el agua, el azúcar, el dióxido de carbono y el dioxígeno, están constituidas por moléculas.A modo de ejemplo consideremos la sustancia agua:Cuando se representa la sustancia agua mediante la fórmula H2O, lo que se está representando es la molécula de agua, por eso se llama fórmula molecular.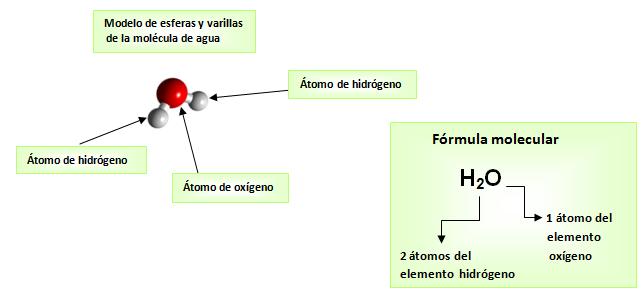 En las fórmulas, el subíndice que está a la derecha y debajo de cada símbolo es la atomicidad, es decir el número de átomos de cada elemento en la molécula. Cuando la atomicidad es 1 no se escribe el subíndice.
En las fórmulas, el subíndice que está a la derecha y debajo de cada símbolo es la atomicidad, es decir el número de átomos de cada elemento en la molécula. Cuando la atomicidad es 1 no se escribe el subíndice.
Reacciones químicas a nivel molecular

REACCIONES QUÍMICAS A NIVEL MOLECULAR
¿Qué sucede con los átomos y las moléculas durante las reacciones químicas?
 Consideremos como ejemplo la reacción de combustión del metano (CH4), principal componente del gas natural utilizado como recurso energético en muchos hogares. En una combustión, una sustancia combustible (en este ejemplo el CH4) reacciona con el O2 presente en el aire. En presencia de suficiente dioxígeno, sólo se obtienen dos productos de la combustión: agua y dióxido de carbono. Cuando sólo se obtienen estos dos productos se le llama combustión completa.Una reacción química se representa mediante una ecuación química. Para escribirla se debe seguir la siguiente regla: las fórmulas de los reactivos se escriben a la izquierda, las de los productos a la derecha, separadas ambas por una flecha que indica el sentido de la reacción.
Consideremos como ejemplo la reacción de combustión del metano (CH4), principal componente del gas natural utilizado como recurso energético en muchos hogares. En una combustión, una sustancia combustible (en este ejemplo el CH4) reacciona con el O2 presente en el aire. En presencia de suficiente dioxígeno, sólo se obtienen dos productos de la combustión: agua y dióxido de carbono. Cuando sólo se obtienen estos dos productos se le llama combustión completa.Una reacción química se representa mediante una ecuación química. Para escribirla se debe seguir la siguiente regla: las fórmulas de los reactivos se escriben a la izquierda, las de los productos a la derecha, separadas ambas por una flecha que indica el sentido de la reacción.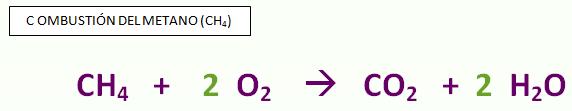 ¿Qué representan los números colocados delante de las fórmulas del O2 y del H2O?Para comprender el significado de los mismos consideremos la reacción química a nivel molecular.
¿Qué representan los números colocados delante de las fórmulas del O2 y del H2O?Para comprender el significado de los mismos consideremos la reacción química a nivel molecular.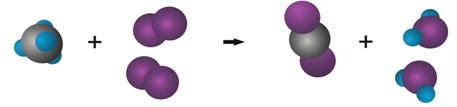 Se necesitan 2 moléculas de O2 por cada molécula de CH4 para que puedan formarse los productos.
Se necesitan 2 moléculas de O2 por cada molécula de CH4 para que puedan formarse los productos.
Átomo

ÁTOMO
Si calculamos la cantidad de moléculas de agua que forman una gota de agua obtenemos un número de aproximadamente 1.670.000.000.000.000.000.000 moléculas de agua. ¡Qué pequeña qué es una molécula de agua! ¡Además, recordemos que entre ellas, hay espacio vacío!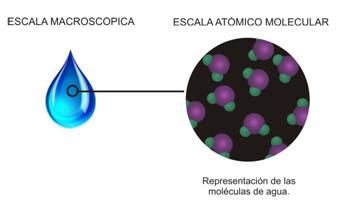 Si cada molécula de agua (H2O) esta formada por tres átomos: dos de hidrógeno y uno de oxígeno. ¡Los átomos son más pequeños! La pequeñez del átomo resulta muy difícil de comprender. El diámetro de un átomo es del orden de 1x10-10m es decir 0,0000000001m, lo que es equivalente a 0,00000001cm o 0,0000001mm.
Si cada molécula de agua (H2O) esta formada por tres átomos: dos de hidrógeno y uno de oxígeno. ¡Los átomos son más pequeños! La pequeñez del átomo resulta muy difícil de comprender. El diámetro de un átomo es del orden de 1x10-10m es decir 0,0000000001m, lo que es equivalente a 0,00000001cm o 0,0000001mm.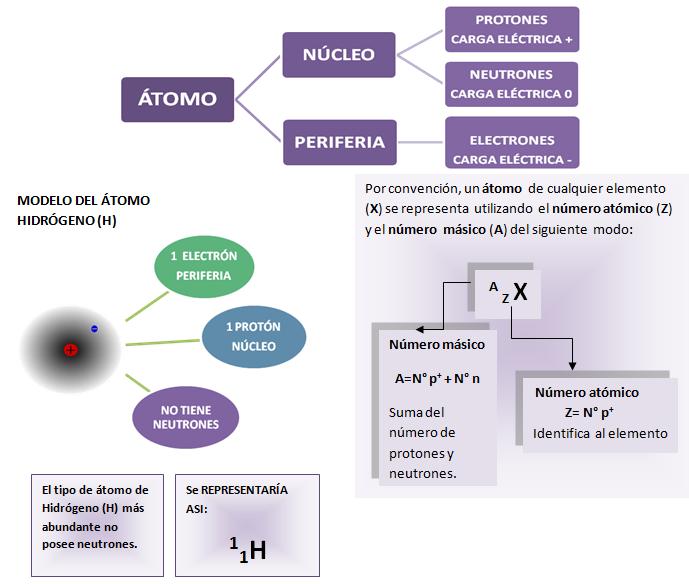
Núcleo atómico. Radiactividad


NÚCLEO ATÓMICO. RADIACTIVIDAD
Se llama radiactividad a la emisión de partículas (alfa y beta) y radiación electromagnética (gama) desde el núcleo atómico de ciertos elementos. Estos núcleos son inestables y se conocen con el nombre de radionucleidos.Los seres vivos estamos expuestos a la radiactividad natural proveniente de los rayos cósmicos y de los elementos radiactivos que forman parte de la corteza terrestre. Estos elementos están presentes en los materiales con los que construimos nuestras viviendas, puentes y calles. También hay elementos radiactivos en el agua y en los alimentos que ingerimos, haciendo que se incorporen a nuestro organismo.Dentro de estos elementos radiactivos naturales se encuentran el 40K, 238U, 222Rn y 232Th. Para tener idea hasta qué punto estamos expuestos a la radiactividad natural, basta pensar que en nuestro planeta, el uranio es más abundante que la plata.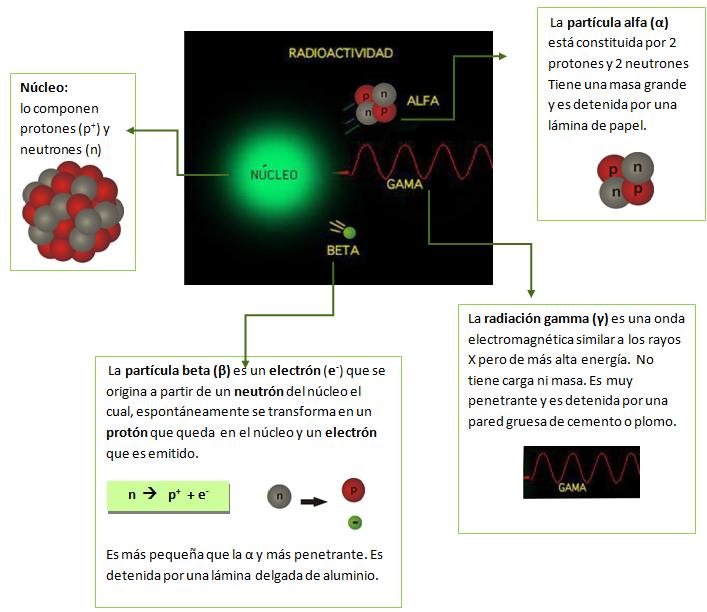 Hay núcleos que emiten partículas α y otros que emiten partículas β; en ambos casos la emisión de estas partículas es acompañada por la emisión de radiación γ.Tanto las partículas α, como las β y la radiación γ son ionizantes, es decir que, cuando interaccionan con la materia “arrancan” electrones de los átomos que la componen, transformándolos en iones.Los efectos biológicos de las radiaciones ionizantes son consecuencia de las interacciones de las partículas α, β y de la radiación γ con las células. La distancia, el tiempo y el blindaje son las medidas básicas de protección frente a las radiaciones ionizantes.
Hay núcleos que emiten partículas α y otros que emiten partículas β; en ambos casos la emisión de estas partículas es acompañada por la emisión de radiación γ.Tanto las partículas α, como las β y la radiación γ son ionizantes, es decir que, cuando interaccionan con la materia “arrancan” electrones de los átomos que la componen, transformándolos en iones.Los efectos biológicos de las radiaciones ionizantes son consecuencia de las interacciones de las partículas α, β y de la radiación γ con las células. La distancia, el tiempo y el blindaje son las medidas básicas de protección frente a las radiaciones ionizantes.
Fisión nuclear. Centrales nucleares

FISIÓN NUCLEAR. CENTRALES NUCLEARES.
Las imágenes muestran 2 artefactos tecnológicos basados en la misma reacción nuclear: la fisión. ¿QUÉ ES LA FISIÓN NUCLEAR?
¿QUÉ ES LA FISIÓN NUCLEAR? El término “neutrón lento” no significa que el neutrón que impacta en el núcleo se desplace a baja velocidad, sino que lo que el término significa es que debe tener determinada velocidad y energía cinética para provocar la fisión.Entre los núcleos fisionables se encuentran el 233U, el 233U y el 239Pu, siendo los 2 últimos los utilizados en los reactores nucleares.Cuando un núcleo se fisiona no siempre lo hace del mismo modo. Los fragmentos de la fisión suelen ser muy variados. En el caso de la fisión del 235U se generan una variedad de productos diferentes, más de 200 correspondientes a aproximadamente 35 elementos distintos, la mayoría de los cuales son radiactivos.¿CUÁL ES EL ORIGEN DE LA ENERGÍA LIBERADA EN LA FISIÓN NUCLEAR?El origen es la transformación de una pequeña parte de la masa nuclear en energía de acuerdo a: E=m.c2La mayor parte de la energía liberada en la fisión se manifiesta como energía cinética de los fragmentos de fisión y de los neutrones los cuales salen disparados a grandes velocidades en todas las direcciones. También parte de la misma se libera en forma de radiación gamma.REACCIÓN EN CADENA
El término “neutrón lento” no significa que el neutrón que impacta en el núcleo se desplace a baja velocidad, sino que lo que el término significa es que debe tener determinada velocidad y energía cinética para provocar la fisión.Entre los núcleos fisionables se encuentran el 233U, el 233U y el 239Pu, siendo los 2 últimos los utilizados en los reactores nucleares.Cuando un núcleo se fisiona no siempre lo hace del mismo modo. Los fragmentos de la fisión suelen ser muy variados. En el caso de la fisión del 235U se generan una variedad de productos diferentes, más de 200 correspondientes a aproximadamente 35 elementos distintos, la mayoría de los cuales son radiactivos.¿CUÁL ES EL ORIGEN DE LA ENERGÍA LIBERADA EN LA FISIÓN NUCLEAR?El origen es la transformación de una pequeña parte de la masa nuclear en energía de acuerdo a: E=m.c2La mayor parte de la energía liberada en la fisión se manifiesta como energía cinética de los fragmentos de fisión y de los neutrones los cuales salen disparados a grandes velocidades en todas las direcciones. También parte de la misma se libera en forma de radiación gamma.REACCIÓN EN CADENA
Periferia atómica

PERIFERIA ATÓMICA
La cantidad de electrones (e-) en un átomo es igual a la de protones (p+), razón por la cual el átomo es eléctricamente neutro. El núcleo central lo componen protones (p+) y neutrones ( n) en tanto que los electrones se encuentran en movimiento en la periferia.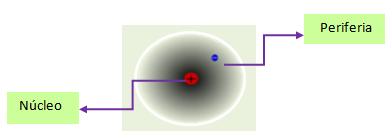 Los electrones presentes en la periferia determinan el comportamiento y las propiedades químicas de los elementos, por lo que el estudio de la periferia, constituye un aspecto esencial de la Química.Debido a la complejidad de las teorías actuales que describen el comportamiento de los electrones en la periferia, sólo se hará una muy breve reseña sobre algunas ideas básicas.
Los electrones presentes en la periferia determinan el comportamiento y las propiedades químicas de los elementos, por lo que el estudio de la periferia, constituye un aspecto esencial de la Química.Debido a la complejidad de las teorías actuales que describen el comportamiento de los electrones en la periferia, sólo se hará una muy breve reseña sobre algunas ideas básicas.
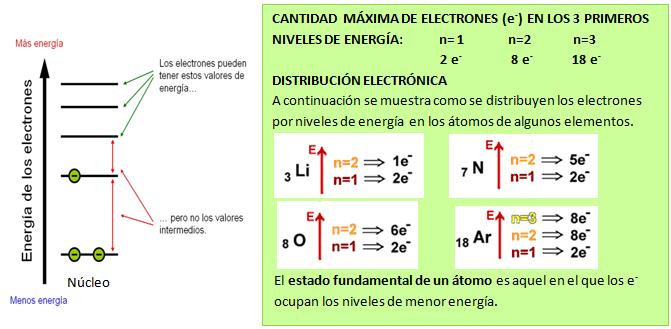
Tabla Periódica de los elementos químicos

TABLA PERIÓDICA DE LOS ELEMENTOS QUÍMICOS
En la Tabla Periódica los elementos químicos están ordenados por su numero atómico (Z) creciente. Cada casilla contiene información del elemento químico: de sus átomos y de la sustancia simple que forma.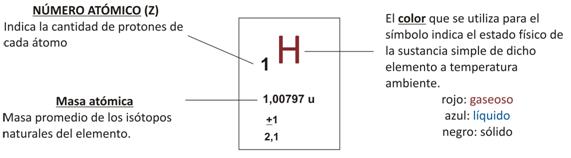 Durante mucho tiempo se buscó la forma de ordenar los elementos químicos, a fines del siglo XIX, Dmittri Mendeleiev (químico Ruso), descubrió la Ley Periódica: Las propiedades químicas de los elementos químicos muestran una repetición periódica cuando se los ordena en orden creciente de número atómico. Como consecuencia, se obtienen columnas de elementos con propiedades similares llamados grupos o familias.En las filas quedan secuencias de elementos cuyas propiedades van variando gradualmente, hasta que se empiezan a repetir y se inicia un nuevo periodo.
Durante mucho tiempo se buscó la forma de ordenar los elementos químicos, a fines del siglo XIX, Dmittri Mendeleiev (químico Ruso), descubrió la Ley Periódica: Las propiedades químicas de los elementos químicos muestran una repetición periódica cuando se los ordena en orden creciente de número atómico. Como consecuencia, se obtienen columnas de elementos con propiedades similares llamados grupos o familias.En las filas quedan secuencias de elementos cuyas propiedades van variando gradualmente, hasta que se empiezan a repetir y se inicia un nuevo periodo.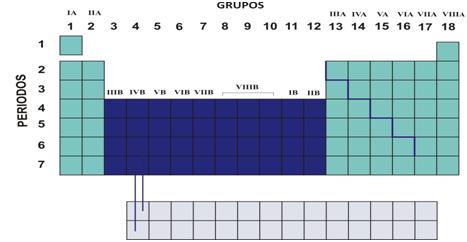 Entonces podemos diferenciar:Grupos o familias:Columnas verticales con elementos químicos de propiedades similares. Es importante aclarar que el Hidrógeno se lo coloca en la primera columna pero no pertenece a esa familia debido a que no tiene propiedades similares a ninguno de los elementos del grupo.Períodos:Filas horizontales con elementos químicos cuyas propiedades varían gradualmente.También podemos dividir la Tabla Periódica en bloques:
Entonces podemos diferenciar:Grupos o familias:Columnas verticales con elementos químicos de propiedades similares. Es importante aclarar que el Hidrógeno se lo coloca en la primera columna pero no pertenece a esa familia debido a que no tiene propiedades similares a ninguno de los elementos del grupo.Períodos:Filas horizontales con elementos químicos cuyas propiedades varían gradualmente.También podemos dividir la Tabla Periódica en bloques: Metales, no metales y semimetales:Recordando que a lo largo de un periodo las propiedades metálicas disminuyen, podríamos decir que los metales se sitúan a la izquierda de la línea escalonada que aparece en la Tabla Periódica y los no metales a la derecha. Algunos elementos se consideran semimetales, son los ubicados en la región intermedia entre los no metales y metales, por ejemplo, el silicio.
Metales, no metales y semimetales:Recordando que a lo largo de un periodo las propiedades metálicas disminuyen, podríamos decir que los metales se sitúan a la izquierda de la línea escalonada que aparece en la Tabla Periódica y los no metales a la derecha. Algunos elementos se consideran semimetales, son los ubicados en la región intermedia entre los no metales y metales, por ejemplo, el silicio.
Metales y No Metales

METALES Y NO METALES
METALESSi estamos en presencia de un objeto brilloso de color entre gris y plateado seguro que afirmaremos que está formado de un metal. Aunque existen excepciones en cuanto al color: el Oro es amarillo y el Cobre rojizo. Por ejemplo, una bombilla de alpaca está fabricada con una aleación de Zinc, Cobre y Níquel. Si vemos que alguien va a tocar un enchufe con la bombilla, le diremos “cuidado” te puede “dar corriente”, es porque sabemos que los metales son buenos conductores de la electricidad. También conocemos cómo puede este metal transmitir el calor a la hora de tomar el mate.Otras características destacadas de los metales son la maleabilidad y la ductilidad, propiedades que permiten la fabricación de diversos objetos metálicos. La maleabilidad significa que con ellos se pueden fabricar láminas, como las chapas de Zinc. La ductilidad es la propiedad que tienen los metales de formar hilos, el Cobre es muy dúctil y además un muy buen conductor de la corriente eléctrica por ello se utiliza en los cables eléctricos.
Por ejemplo, una bombilla de alpaca está fabricada con una aleación de Zinc, Cobre y Níquel. Si vemos que alguien va a tocar un enchufe con la bombilla, le diremos “cuidado” te puede “dar corriente”, es porque sabemos que los metales son buenos conductores de la electricidad. También conocemos cómo puede este metal transmitir el calor a la hora de tomar el mate.Otras características destacadas de los metales son la maleabilidad y la ductilidad, propiedades que permiten la fabricación de diversos objetos metálicos. La maleabilidad significa que con ellos se pueden fabricar láminas, como las chapas de Zinc. La ductilidad es la propiedad que tienen los metales de formar hilos, el Cobre es muy dúctil y además un muy buen conductor de la corriente eléctrica por ello se utiliza en los cables eléctricos. A temperatura ambiente, los metales se presentan en estado sólido, a excepción del Galio y del Mercurio. El Mercurio fue utilizado en los termómetros de líquido hasta hace muy pocos años pero debido a su toxicidad fue sustituido por una aleación de Galio, Indio y Estaño.
A temperatura ambiente, los metales se presentan en estado sólido, a excepción del Galio y del Mercurio. El Mercurio fue utilizado en los termómetros de líquido hasta hace muy pocos años pero debido a su toxicidad fue sustituido por una aleación de Galio, Indio y Estaño.  En la Tabla Periódica los elementos de carácter metálico se encuentran ubicados a la izquierda de la misma y sus propiedades metálicas se hacen menos marcadas a medida que se encuentran más hacia la derecha.Existen elementos que tienen propiedades intermedias, se llaman semimetales: boro, silicio, germanio y arsénico.NO METALESLos colores de los semimetales son muy variados verde, rojo, violeta y también incoloros. Son muy pocos los que presentan brillo.A 20 ºC, algunos son sólidos y otros gaseosos, en tanto que el bromo es líquido.No son maleables ni dúctiles. En general, no son buenos conductores del calor ni de la corriente eléctrica, salvo el grafito (una forma del elemento Carbono), que es bastante buen conductor de la electricidad.Excepto el Hidrógeno, los no metales se encuentran a la derecha de la Tabla Periódica
En la Tabla Periódica los elementos de carácter metálico se encuentran ubicados a la izquierda de la misma y sus propiedades metálicas se hacen menos marcadas a medida que se encuentran más hacia la derecha.Existen elementos que tienen propiedades intermedias, se llaman semimetales: boro, silicio, germanio y arsénico.NO METALESLos colores de los semimetales son muy variados verde, rojo, violeta y también incoloros. Son muy pocos los que presentan brillo.A 20 ºC, algunos son sólidos y otros gaseosos, en tanto que el bromo es líquido.No son maleables ni dúctiles. En general, no son buenos conductores del calor ni de la corriente eléctrica, salvo el grafito (una forma del elemento Carbono), que es bastante buen conductor de la electricidad.Excepto el Hidrógeno, los no metales se encuentran a la derecha de la Tabla Periódica
No Metal-Hidrógeno

NO METAL - HIDRÓGENO
Autos del futuro… La búsqueda de alternativas al petróleo como fuente energética ha permitido descubrir las bondades del dihidrógeno como combustible. La principal diferencia entre un auto convencional y uno propulsado por dihidrógeno está en la construcción del tanque. Este tiene una capacidad de 120 litros y el dihidrógeno contenido en él debe ser almacenado a una presión de 5 atmósferas y debe mantenerse frío. Un automóvil que funciona con dihidrógeno, con un tanque lleno, puede recorrer hasta 400 kilómetros.
La búsqueda de alternativas al petróleo como fuente energética ha permitido descubrir las bondades del dihidrógeno como combustible. La principal diferencia entre un auto convencional y uno propulsado por dihidrógeno está en la construcción del tanque. Este tiene una capacidad de 120 litros y el dihidrógeno contenido en él debe ser almacenado a una presión de 5 atmósferas y debe mantenerse frío. Un automóvil que funciona con dihidrógeno, con un tanque lleno, puede recorrer hasta 400 kilómetros. Este tipo de mecánica tiene la ventaja de que sólo expulsa vapor de agua como emisión de desechos. Así planteado parece muy conveniente, sin embargo, para almacenar el dihidrógeno se debe alcanzar una temperatura de –253 °C y eso requiere de una costosa y desarrollada tecnología. Masificar esta solución nos llevará tiempo..
Este tipo de mecánica tiene la ventaja de que sólo expulsa vapor de agua como emisión de desechos. Así planteado parece muy conveniente, sin embargo, para almacenar el dihidrógeno se debe alcanzar una temperatura de –253 °C y eso requiere de una costosa y desarrollada tecnología. Masificar esta solución nos llevará tiempo..
Bioelementos

BIOELEMENTOS
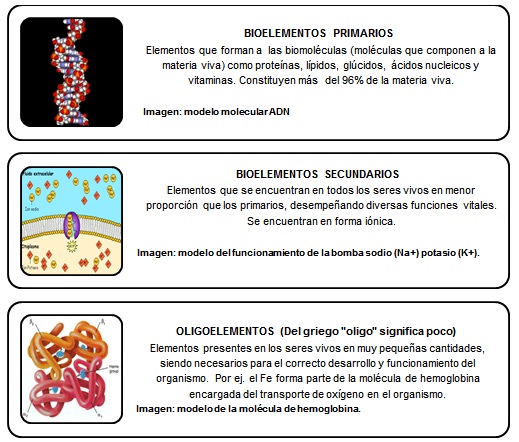
¿DE QUÉ ESTAMOS HECHOS?Todos los seres humanos, a pesar de nuestras diferencias tenemos algo en común: estamos hechos de los mismos elementos químicos. Son muchos los elementos presentes en la composición de todos los seres vivos, animales y vegetales y a estos se les da el nombre de bioelementos. Ninguno de estos elementos es exclusivo de la materia viva pues también se encuentran formando parte de la materia inerte. ¿Cuáles son algunos de los bioelementos más importantes?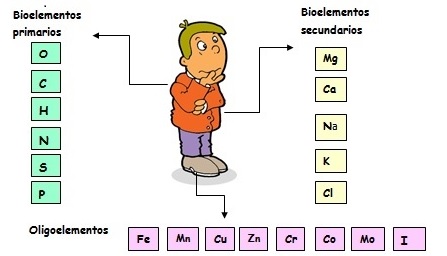
Estabilidad química

ESTABILIDAD QUÍMICA
Los átomos tienden a un estado de menor energía, lo que implica una mayor estabilidad química. Esta es la clave para entender porqué interactuán entre ellos estableciendo diferentes enlaces químicos (uniones químicas).La mayoría de los átomos sin unirse o enlazarse presentan situaciones de baja estabilidad química. Sin embargo, los gases inertes (grupo 18), se caracterizan por su alta estabilidad química, es decir, no reaccionan salvo raras excepciones. La gran estabilidad química de los gases inertes se asocia a que tienen 8 electrones en su último nivel, esto se conoce como regla del octeto (excepto los átomos de He).Los átomos tienden a ganar, perder o compartir electrones quedando con 8 electrones en su nivel más externo, adquiriendo de este modo una estructura electrónica como la que tiene el gas noble más cercano en la Tabla Periódica.
 Los metales presentan una tendencia a perder electrones, por ejemplo, los átomos de Sodio (grupo 1), tienen un electrón de valencia y tienden a perderlo quedando con la distribución electrónica del Neón. Mientras que los no metales tienden a ganar electrones. Los átomos de cloro (grupo 17), por ejemplo, tienden a ganar un electrón, adquiriendo la distribución electrónica del Argón.Diagrama de LewisEl diagrama de Lewis consiste en representar los electrones del último nivel de energía (electrones de valencia) con puntitos alrededor del símbolo del elemento.
Los metales presentan una tendencia a perder electrones, por ejemplo, los átomos de Sodio (grupo 1), tienen un electrón de valencia y tienden a perderlo quedando con la distribución electrónica del Neón. Mientras que los no metales tienden a ganar electrones. Los átomos de cloro (grupo 17), por ejemplo, tienden a ganar un electrón, adquiriendo la distribución electrónica del Argón.Diagrama de LewisEl diagrama de Lewis consiste en representar los electrones del último nivel de energía (electrones de valencia) con puntitos alrededor del símbolo del elemento. Veamos la estructura de Lewis para algunos elementos representativos …
Veamos la estructura de Lewis para algunos elementos representativos …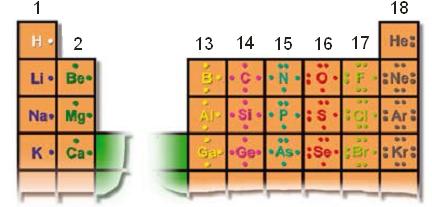 Observaciones:• Para los elementos representativos de los grupos 1 y 2 la cantidad de electrones de valencia coincide con el número de grupo, y para los demás con el segundo dígito del número de grupo, por ejemplo, grupo 13: 3 electrones de valencia. (excepto el He del grupo 18, que tiene 2 electrones de valencia).• En un grupo, las propiedades químicas de los elementos son similares, esto se debe a que tienen la misma cantidad de electrones de valencia.
Observaciones:• Para los elementos representativos de los grupos 1 y 2 la cantidad de electrones de valencia coincide con el número de grupo, y para los demás con el segundo dígito del número de grupo, por ejemplo, grupo 13: 3 electrones de valencia. (excepto el He del grupo 18, que tiene 2 electrones de valencia).• En un grupo, las propiedades químicas de los elementos son similares, esto se debe a que tienen la misma cantidad de electrones de valencia.
Enlace químico

ENLACE QUÍMICO
Regla del octeto: los átomos tienden a interaccionar con otros adquiriendo 8 electrones en el nivel más externo de energía, estableciéndose entre ellos un enlace químico.Los metales presentan una tendencia a perder electrones, mientras que los no metales tienden a ganar electrones. De esta manera, básicamente, los átomos adquieren una distribución electrónica más estable, similar a la del gas inerte más próximo en la Tabla Periódica.Se puede realizar las siguientes simplificaciones:• Entre un metal y no metal se transfieren electrones. El metal pierde, el no metal gana. Los átomos pierden su neutralidad eléctrica, transformándose en iones. Entre los iones se establece una fuerza electrostática llamada ENLACE IÓNICO.• Entre átomos de no metales se comparten pares de electrones. Se produce un ENLACE COVALENTE. Esta compartición, en otros casos, no siempre es equitativa:Enlace covalente no polar los pares de electrones están a la misma distancia de los átomos enlazados. Las moléculas formadas por la unión de los átomos son no polares.Enlace covalente polar los pares de electrones no están a la misma distancia de los átomos enlazados. Las moléculas formadas tienen una distribución desigual de los electrones.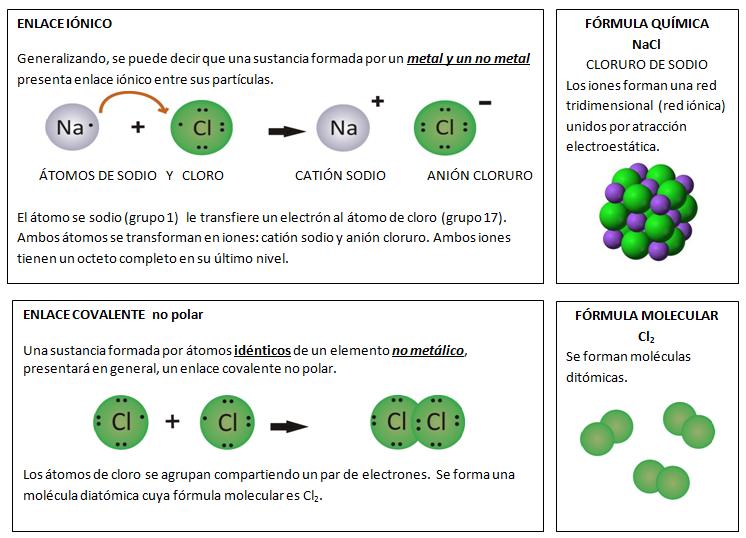
Enlace covalente polar y no polar

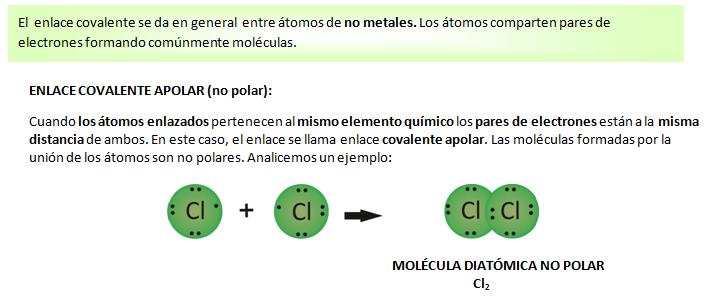
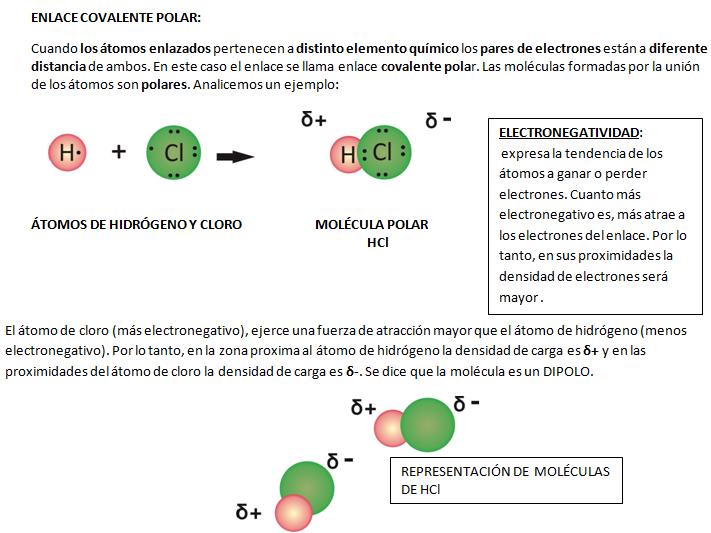
ENLACE COVALENTE APOLAR Y POLAR
Óxidos. Introducción

ÓXIDOS INTRODUCCIÓN
 Los óxidos son sustancias que están muy presentes en nuestra vida cotidiana.Como resultado de la actividad humana, toneladas de óxidos de carbono (CO y CO2), óxido de azufre (SO2) y óxidos de nitrógeno (principalmente NO y NO2) son vertidos diariamente a la atmósfera. Estos óxidos gaseosos son producidos también naturalmente como resultado de procesos naturales como la respiración de los seres vivos, los volcanes, incendios forestales, etc.En la tropósfera tienen lugar una serie de reacciones químicas que transforman el dióxido de azufre (SO2) en ácido sulfúrico y los óxidos de nitrógeno (NO y NO2) en ácido nítrico, ambos ácidos causantes de la lluvia ácida.Por otra parte, el dióxido de carbono (CO2), uno de los gases que el hombre vierte a la atmósfera en mayor cantidad, es una de las sustancias, aunque no la única, responsable del calentamiento global.
Los óxidos son sustancias que están muy presentes en nuestra vida cotidiana.Como resultado de la actividad humana, toneladas de óxidos de carbono (CO y CO2), óxido de azufre (SO2) y óxidos de nitrógeno (principalmente NO y NO2) son vertidos diariamente a la atmósfera. Estos óxidos gaseosos son producidos también naturalmente como resultado de procesos naturales como la respiración de los seres vivos, los volcanes, incendios forestales, etc.En la tropósfera tienen lugar una serie de reacciones químicas que transforman el dióxido de azufre (SO2) en ácido sulfúrico y los óxidos de nitrógeno (NO y NO2) en ácido nítrico, ambos ácidos causantes de la lluvia ácida.Por otra parte, el dióxido de carbono (CO2), uno de los gases que el hombre vierte a la atmósfera en mayor cantidad, es una de las sustancias, aunque no la única, responsable del calentamiento global. Existen también muchos ejemplos de óxidos sólidos a temperatura ambiente como el óxido de calcio conocido con el nombre de cal de fórmula CaO, el óxido de silicio de fórmula SiO2 (principal componente del cuarzo y la arena) y el óxido de aluminio de fórmula Al2O3 (componente principal de piedras preciosas como el zafiro y el rubí).
Existen también muchos ejemplos de óxidos sólidos a temperatura ambiente como el óxido de calcio conocido con el nombre de cal de fórmula CaO, el óxido de silicio de fórmula SiO2 (principal componente del cuarzo y la arena) y el óxido de aluminio de fórmula Al2O3 (componente principal de piedras preciosas como el zafiro y el rubí).
Formulación de óxidos

FORMULACIÓN DE ÓXIDOS
¿Qué es formular?Formular es deducir la fórmula de un compuesto de acuerdo a determinadas reglas.Fórmula química: es una expresión simbólica que indica la proporción relativa de los átomos (o iones) de los diferentes elementos que componen las sustancias.Una manera de deducir la fórmula de un compuesto es empleando los números de oxidación.
 Como se observa en los ejemplos, los óxidos metálicos y los no metálicos se formulan del mismo modo.Muchos elementos como es el caso del Nitrógeno (N), presentan varios números de oxidación, por lo que formarán óxidos distintos según con qué número de oxidación se combinen con el oxígeno.
Como se observa en los ejemplos, los óxidos metálicos y los no metálicos se formulan del mismo modo.Muchos elementos como es el caso del Nitrógeno (N), presentan varios números de oxidación, por lo que formarán óxidos distintos según con qué número de oxidación se combinen con el oxígeno.
Nomenclatura de óxidos

NOMENCLATURA DE ÓXIDOS
Se denomina nomenclatura al conjunto de reglas que se utilizan para nombrar las sustancias.Existen 3 sistemas de nomenclatura: Para los óxidos, las 2 formas de nomenclatura que se utilizan son la nomenclatura de Stock y la sistemática.
Para los óxidos, las 2 formas de nomenclatura que se utilizan son la nomenclatura de Stock y la sistemática.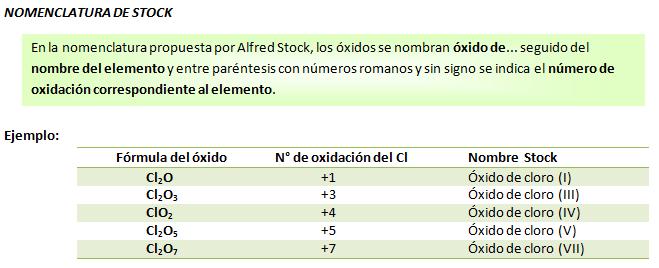
El convertidor catalítico

EL CONVERTIDOR CATALÍTICO
La mayoría de los autos modernos están equipados con un convertidor catalítico que tiene como finalidad disminuir el daño que los gases del caño de escape causan en las personas y el medio ambiente.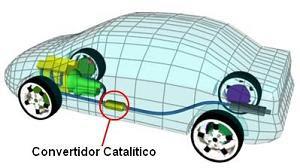 En los motores a explosión, además de CO2, CO y H2O, productos de la combustión del combustible (nafta, gas oil) se producen otros gases como NO y NO2. Estos se producen debido a que la elevada temperatura del motor, favorece la reacción entre el N2 y O2 que componen el aire que entra al motor, originando NO, el cual reacciona rápidamente con el O2 formando NO2.Por lo tanto, por el caño de escape de un automóvil sale una mezcla de varios gases: N2, CO2, CO, H2O, NO y NO2.El CO es muy perjudicial para la salud de las personas y el NO y NO2 son perjudiciales para el medio ambiente pues luego de experimentar transformaciones en la atmósfera, causan el fenómeno conocido como lluvia ácida.El convertidor catalítico logra transformar alrededor del 90% de estos gases nocivos en otros menos perjudiciales.
En los motores a explosión, además de CO2, CO y H2O, productos de la combustión del combustible (nafta, gas oil) se producen otros gases como NO y NO2. Estos se producen debido a que la elevada temperatura del motor, favorece la reacción entre el N2 y O2 que componen el aire que entra al motor, originando NO, el cual reacciona rápidamente con el O2 formando NO2.Por lo tanto, por el caño de escape de un automóvil sale una mezcla de varios gases: N2, CO2, CO, H2O, NO y NO2.El CO es muy perjudicial para la salud de las personas y el NO y NO2 son perjudiciales para el medio ambiente pues luego de experimentar transformaciones en la atmósfera, causan el fenómeno conocido como lluvia ácida.El convertidor catalítico logra transformar alrededor del 90% de estos gases nocivos en otros menos perjudiciales.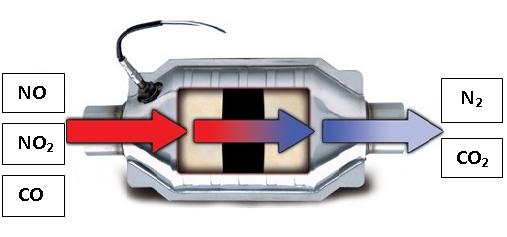
Ácidos y Bases

ÁCIDOS Y BASES
 Las sustancias presentan, al entrar en contacto con agua, comportamiento ácido, básico o neutro. Para averiguar si una sustancia tiene comportamiento ácido o básico se usa el papel tornasol. Hay distintos tipos de papel tornasol.Si el papel tornasol azul cambia a rojo el carácter de la sustancia es ácido.
Las sustancias presentan, al entrar en contacto con agua, comportamiento ácido, básico o neutro. Para averiguar si una sustancia tiene comportamiento ácido o básico se usa el papel tornasol. Hay distintos tipos de papel tornasol.Si el papel tornasol azul cambia a rojo el carácter de la sustancia es ácido. Si el papel tornasol rojo cambia a azul se puede afirmar que la sustancia tiene carácter básico.
Si el papel tornasol rojo cambia a azul se puede afirmar que la sustancia tiene carácter básico.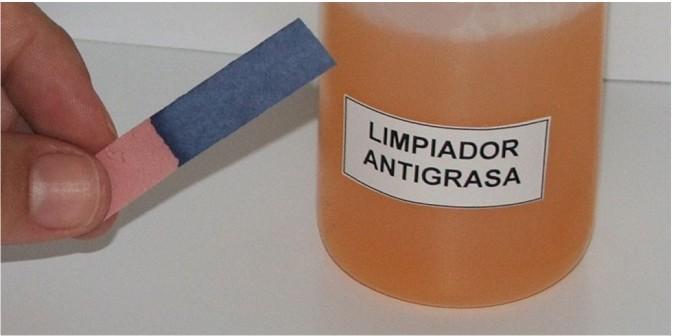
 FUERZA DE ÁCIDOS Y BASESLa lluvia normal es ligeramente ácida por lo que el papel tornasol queda de color rojo. Pero hay determinadas zonas del planeta donde presenta mayor acidez. La acidez de la lluvia empieza a ser preocupante cuando su valor de pH es inferior a 5,6. Pero, ¿qué significa pH 5,6? El valor de pH sirve para medir el grado de acidez o basicidad de una solución. Una forma de medir el pH es usar el papel de pH universal.Se moja la tirilla de papel y se compara el color obtenido con las referencias de colores indicadas en la caja del papel de pH universal. Así se obtiene un valor de pH:Si el pH es 7 la solución es neutra.Si el pH es mayor a 7 la solución es básica (o alcalina).Si el pH es menor a 7 la solución es ácida.
FUERZA DE ÁCIDOS Y BASESLa lluvia normal es ligeramente ácida por lo que el papel tornasol queda de color rojo. Pero hay determinadas zonas del planeta donde presenta mayor acidez. La acidez de la lluvia empieza a ser preocupante cuando su valor de pH es inferior a 5,6. Pero, ¿qué significa pH 5,6? El valor de pH sirve para medir el grado de acidez o basicidad de una solución. Una forma de medir el pH es usar el papel de pH universal.Se moja la tirilla de papel y se compara el color obtenido con las referencias de colores indicadas en la caja del papel de pH universal. Así se obtiene un valor de pH:Si el pH es 7 la solución es neutra.Si el pH es mayor a 7 la solución es básica (o alcalina).Si el pH es menor a 7 la solución es ácida.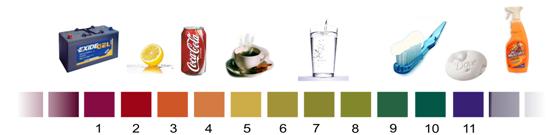 Cada unidad que varía el pH cambia la acidez en un factor de 10. Esto significa que si el pH de la lluvia registrado es 4,6, la lluvia está 10 veces más ácida. Si el pH es 3,6 es 100 veces más ácida.
Cada unidad que varía el pH cambia la acidez en un factor de 10. Esto significa que si el pH de la lluvia registrado es 4,6, la lluvia está 10 veces más ácida. Si el pH es 3,6 es 100 veces más ácida.
Sección 33
Sección 34
Sección 35
Sección 36
Sección 38
Sección 40
Sección 41
Sección 42
Sección 43
Sección 44
Sección 45
Sección 46
Sección 47
Sección 48
Sección 49
Sección 50
Sección 51
Sección 52
