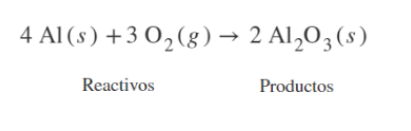GLOSARIO DE QUÍMICA
GLOSARIO DE QUÍMICA
Especial | A | B | C | D | E | F | G | H | I | J | K | L | M | N | Ñ | O | P | Q | R | S | T | U | V | W | X | Y | Z | TODAS
E |
|---|
Ecuación QuímicaLa ecuación química es la representación de una reacción química. En
las ecuaciones químicas se usan las fórmulas
químicas
de
los
reactivos
y
productos. Las ecuaciones químicas están balanceadas cuando la cantidad de átomos de cada elemento en los reactivos es igual a la cantidad de átomos de cada elemento en los productos. Es frecuente que en las ecuaciones químicas se muestre el estado de agregación de cada sustancia.
|
Electrón |
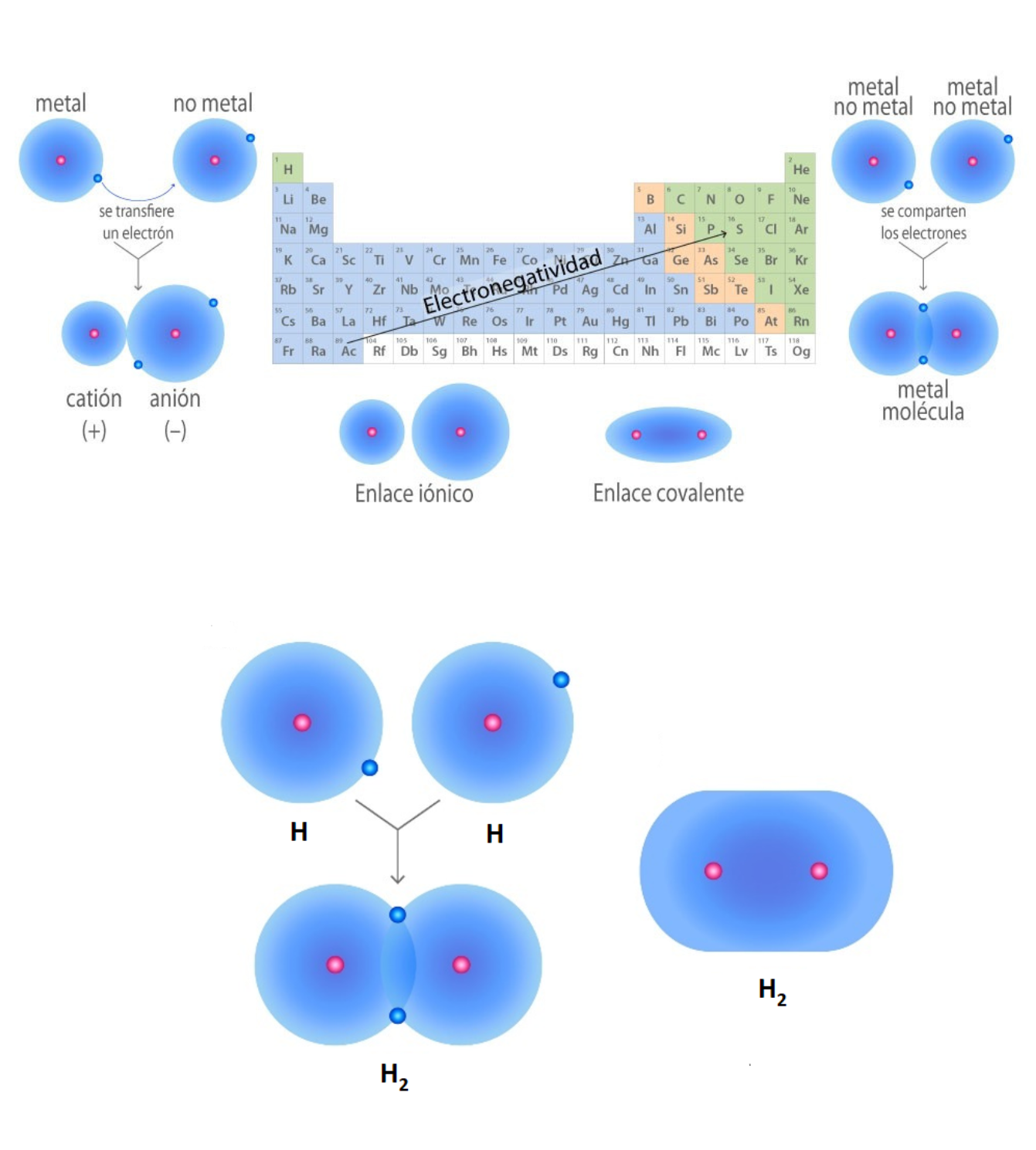
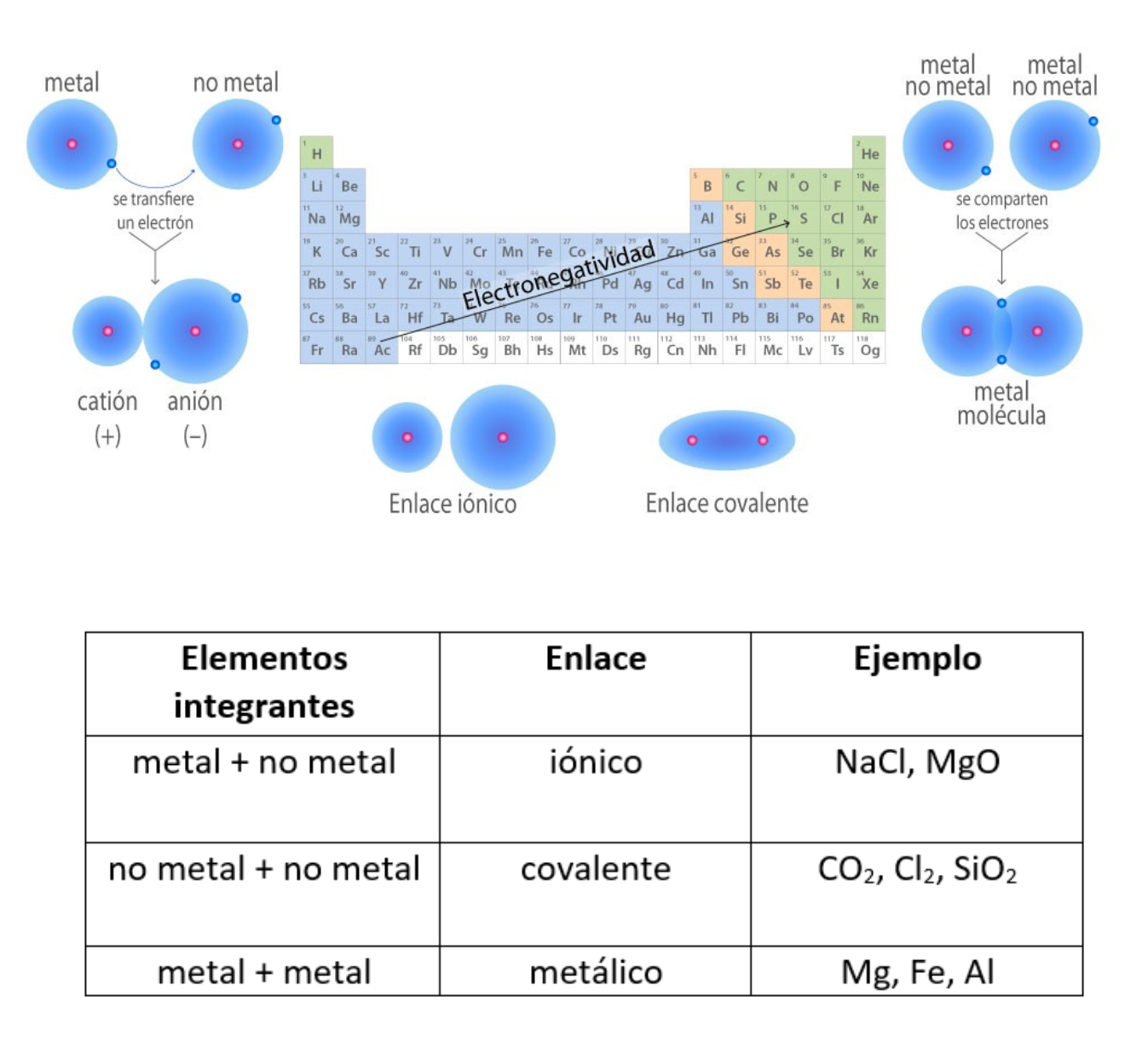
ElectronegatividadLa electronegatividad es la capacidad de un átomo que está unido a otro átomo de atraer electrones del enlace. Cuanto mayor sea la electronegatividad, la capacidad de atraer los electrones del enlace será mayor. La diferencia entre las electronegatividades de los átomos en un enlace determina el tipo de enlace químico.
|
Elemento Químico
El elemento químico es una sustancia que no se puede descomponer en otra sustancia más simple. Cada elemento químico se representa con un símbolo químico formado por una letra o por dos letras. Por ejemplo, el elemento nitrógeno se representa como N, y el elemento calcio como Ca. Todos los elementos conocidos se ordenan en la Tabla Periódica. Todos los átomos de un mismo elemento tienen la misma cantidad de protones.
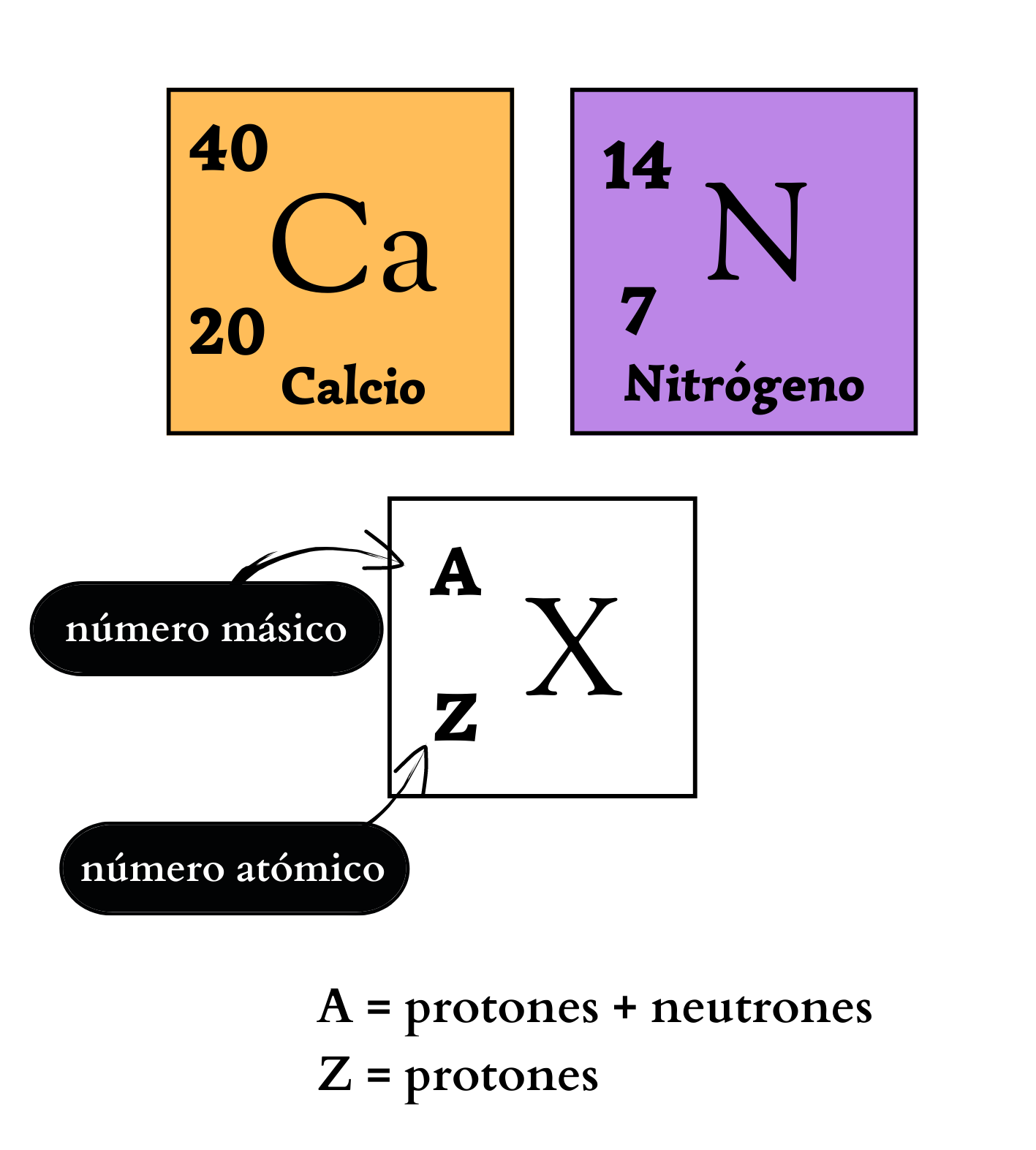
Elemento químico Representación de un elemento en la tabla periódica. De forma genérica, con la letra equis mayúscula hay un símbolo químico de un elemento. Arriba a la izquierda, como superíndice, la letra a mayúscula representa el número másico, que indica la cantidad de protones más la cantidad de neutrones. Abajo a la izquierda, como subíndice, la letra mayúscula zeta representa la cantidad de protones. Ejemplos Como ejemplos se indican: El elemento calcio, C mayúscula, a minúscula, número másico 40, y número atómico 20. Y el elemento nitrógeno, ene mayúscula, número másico 14, y número atómico 7. |
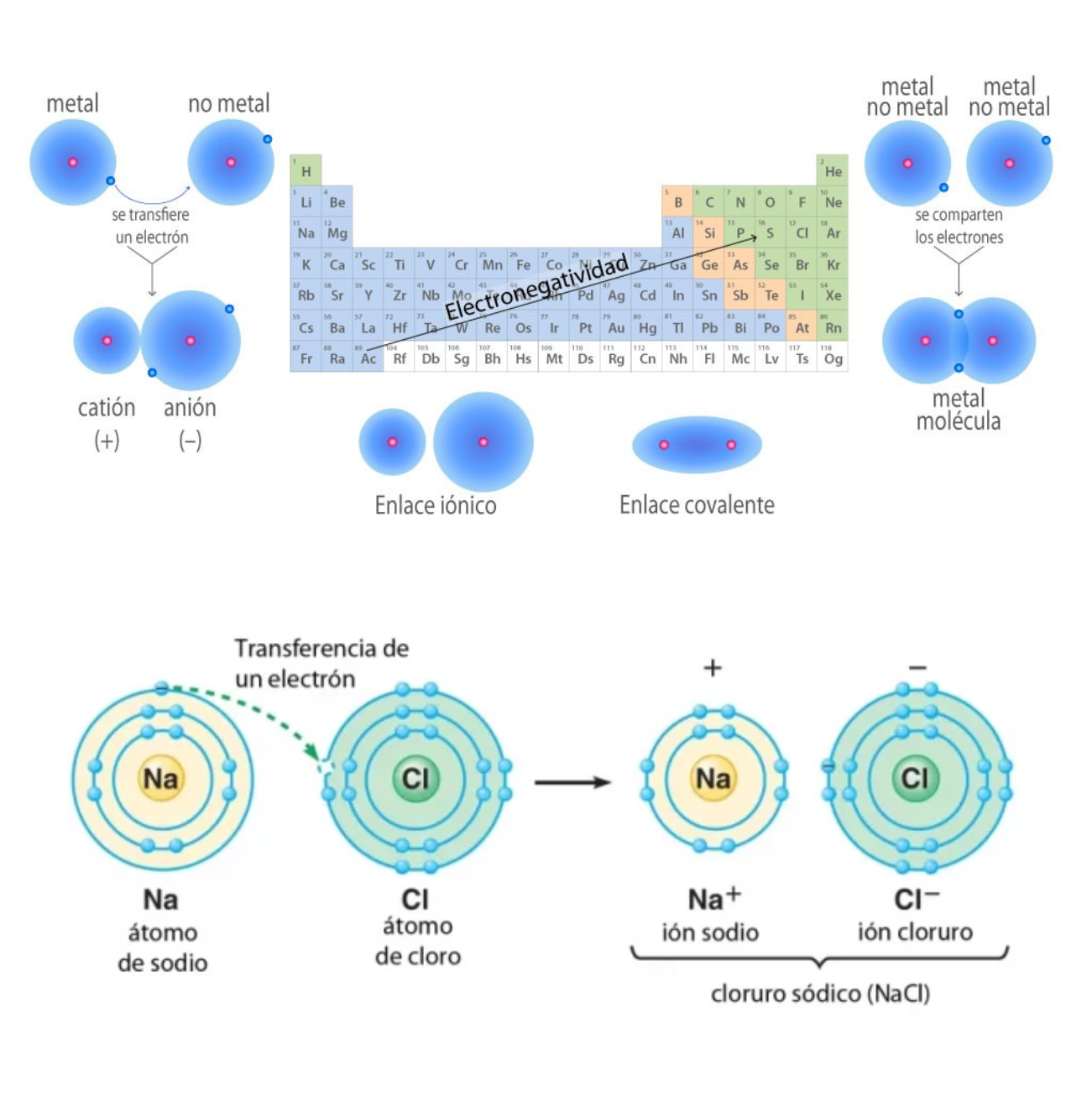
Enlace CovalenteEl
enlace covalente es un enlace
químico
formado
entre dos átomos
que
comparten electrones. La diferencia de electronegatividad entre los átomos que se enlazan puede ser de nula a intermedia. Se llama enlace covalente no polar cuando los electrones del enlace se comparten por igual entre los átomos. En este caso la diferencia de electronegatividad es nula. Se llama enlace covalente polar cuando los electrones del enlace no se comparten por igual entre los átomos. En este caso la diferencia de electronegatividad es intermedia.
|
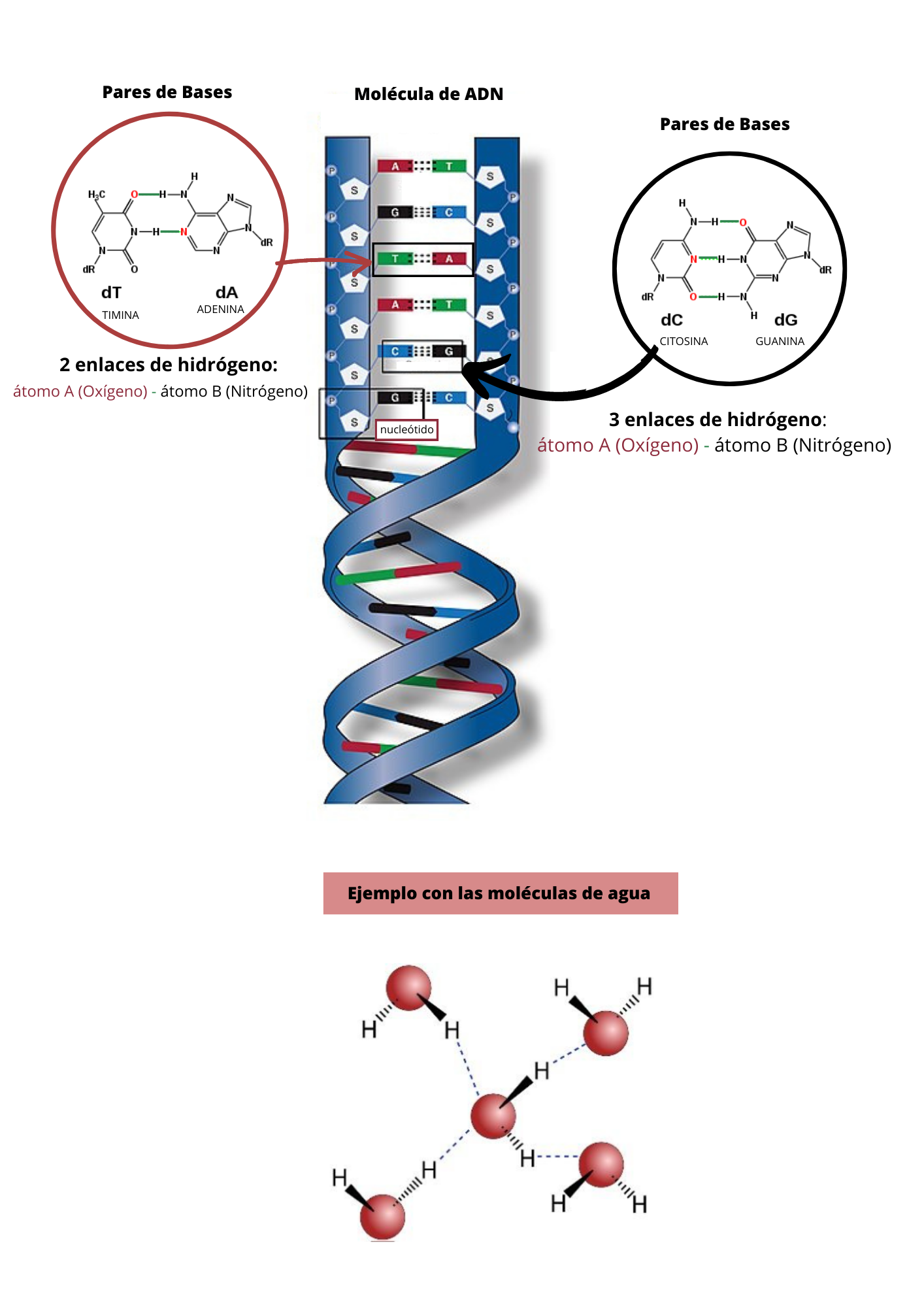
Enlace de hidrógenoEl enlace de hidrógeno es un tipo de enlace de baja energía. El enlace de hidrógeno se establece entre un átomo de hidrógeno y un átomo electronegativo A. Para que se forme el enlace de hidrógeno, el átomo de hidrógeno debe estar unido por enlace covalente a un átomo electronegativo B. El Enlace de Hidrógeno antes se llamaba Puente de Hidrógeno. Por lo general A y B, son oxígeno (O), nitrógeno (N), flúor (F) o cloro (Cl).
|
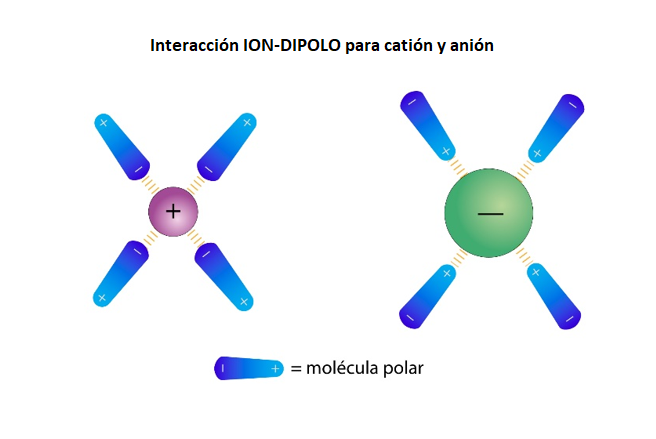
Enlace Ion-Dipolo |
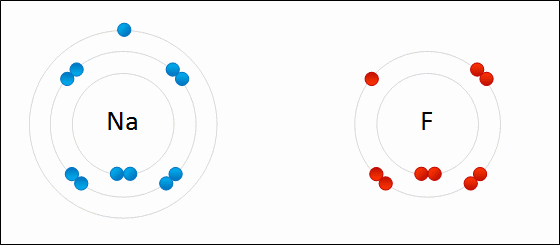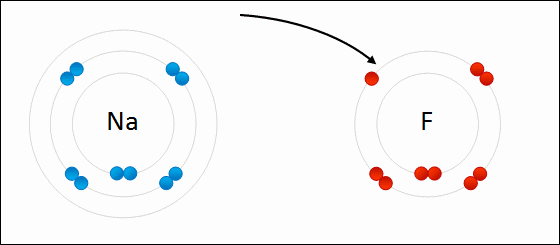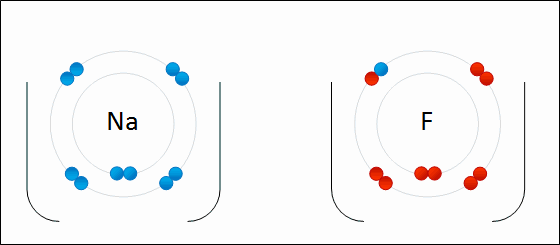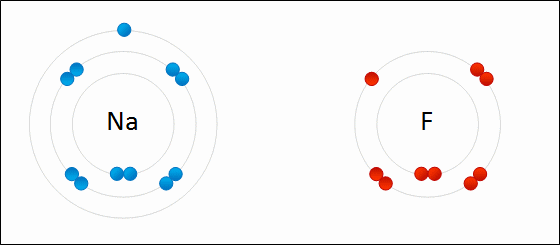
Enlace IónicoEl
enlace iónico es el enlace que mantiene unido a los cationes y
aniones en las sustancias
iónicas. Un enlace iónico es la atracción electrostática entre las cargas eléctricas de cationes y aniones. Los cationes y aniones se forman a partir de átomos con una diferencia de electronegatividad muy grande.
|
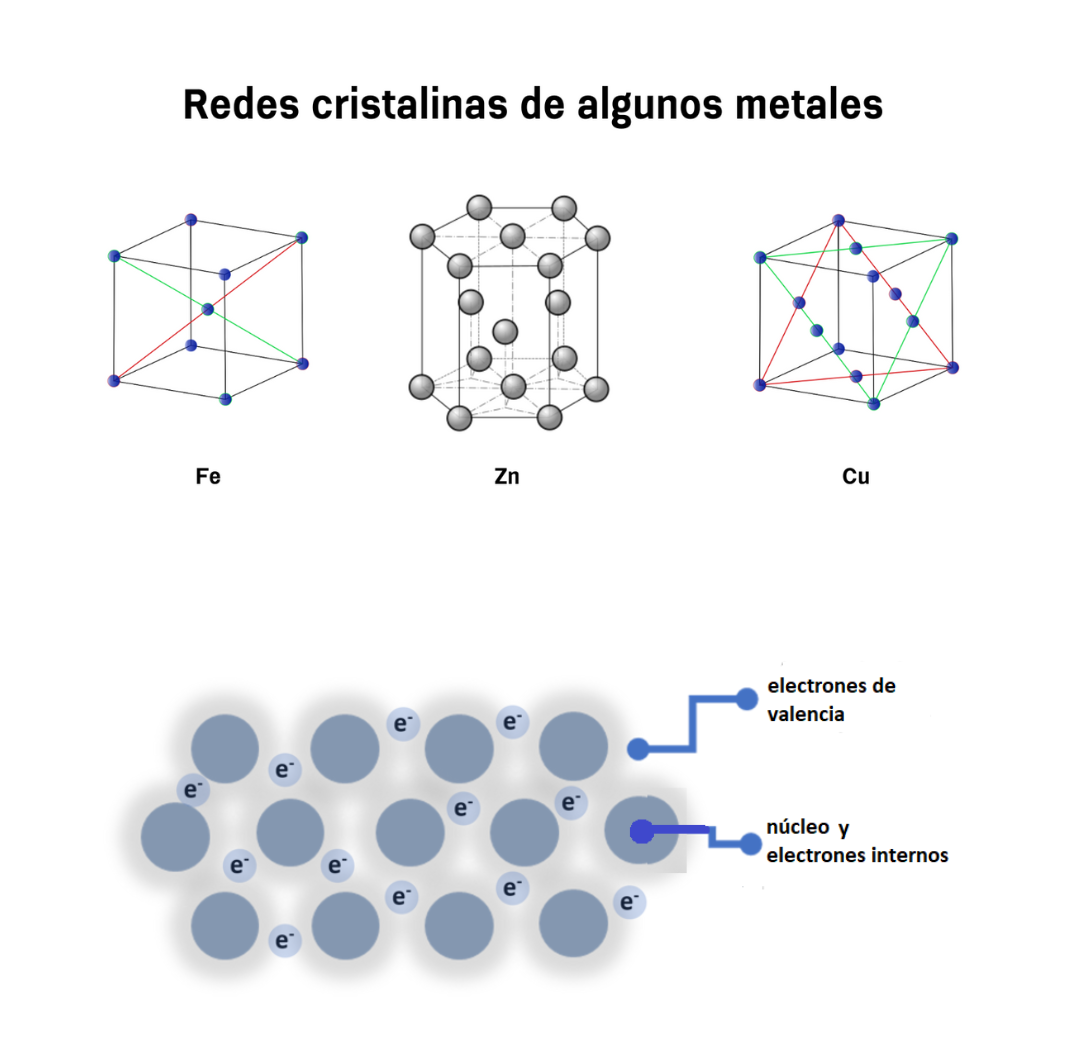
Enlace MetálicoEl enlace metálico es un enlace químico que mantiene unidos a los átomos de los metales. En el enlace metálico los núcleos y los electrones internos de los átomos se encuentran ordenados en una red cristalina. Los electrones de valencia de esos átomos se mueven de forma libre a lo largo de todo el metal. Los electrones de valencia se comparten entre todos los átomos del metal. Los electrones de valencia del metal están deslocalizados. El enlace metálico genera características en los metales. Los metales:
|
Enlace Químico (Unión Química)El
enlace químico es la fuerza que une átomos,
moléculas
o
iones
entre
sí. Los enlaces químicos generan grupos de átomos, moléculas o iones unidos entre sí de forma estable. Por ejemplo, el enlace que existe entre 2 átomos de hidrógeno (H) forma la molécula de dihidrógeno (H2). Tipos de enlaces:
|
Enlaces de Baja EnergíaSon
enlaces
químicos
que
poseen baja energía
de enlace
y
actúan a distancias muy cortas. Los enlaces de baja energía tienen menor energía que los enlaces:
Existen diferentes tipos de enlaces de baja energía:
|
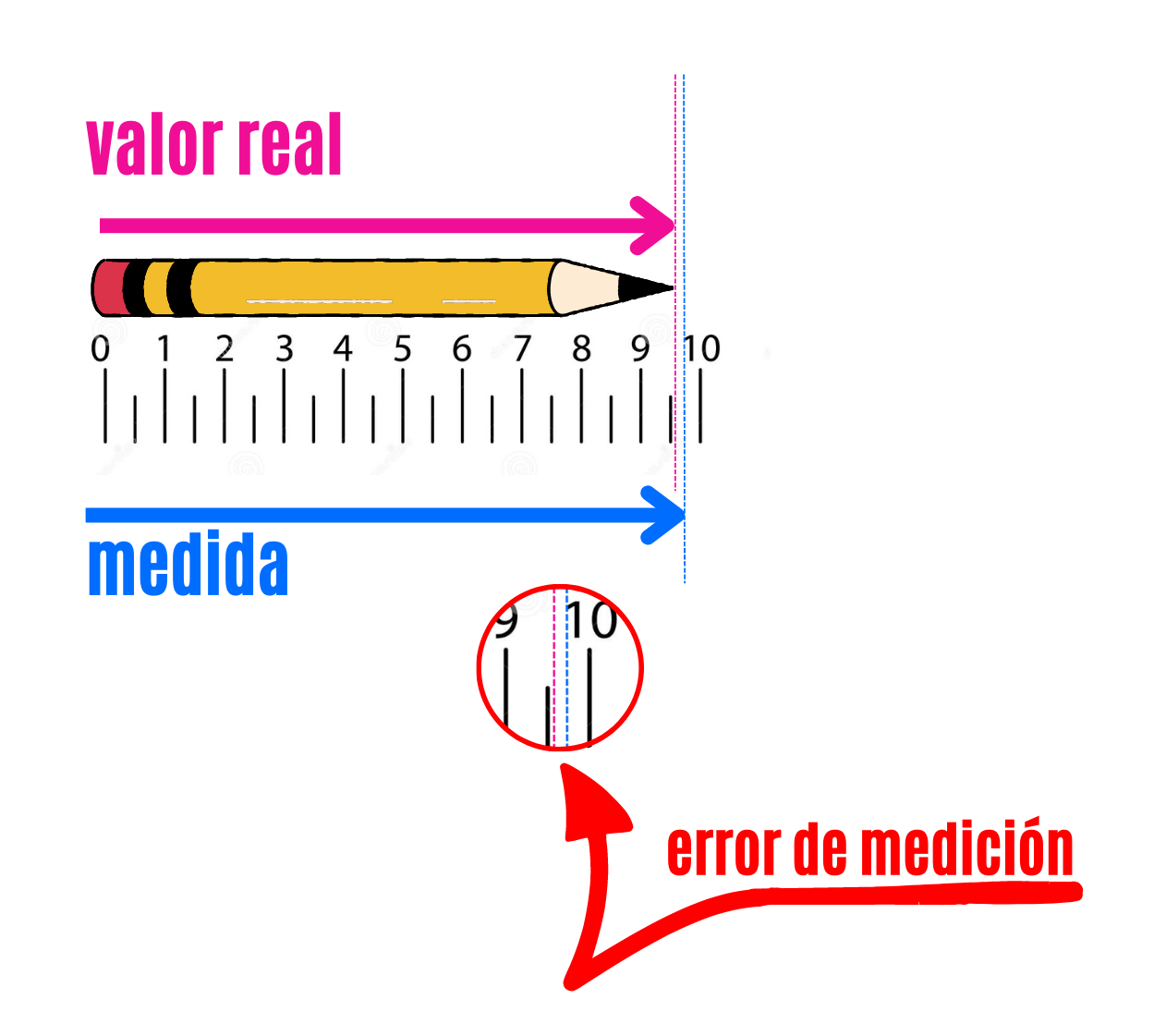
Error de Medición |
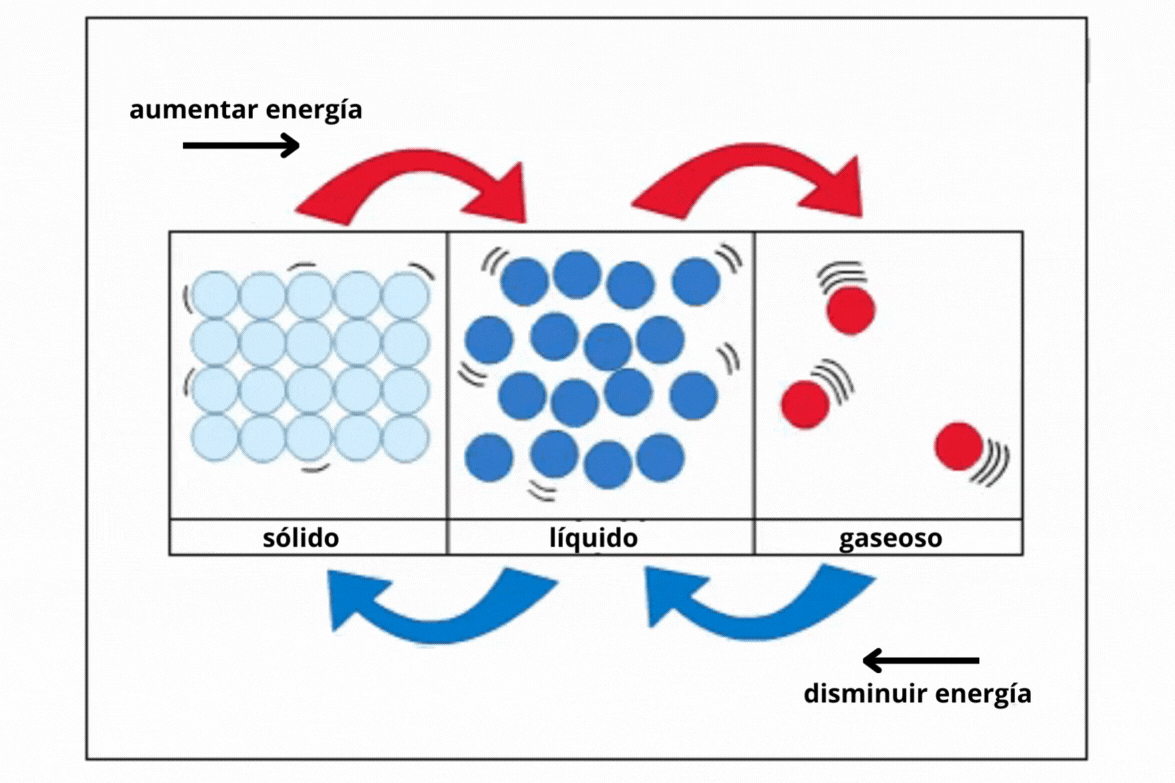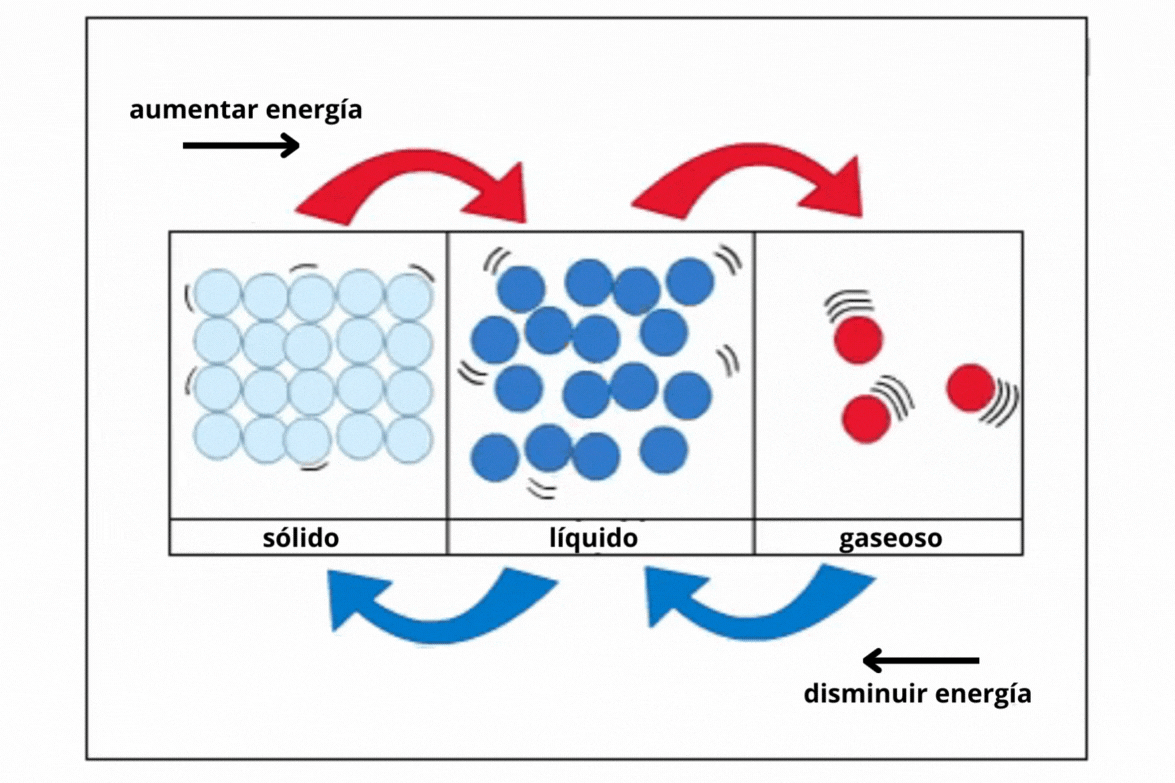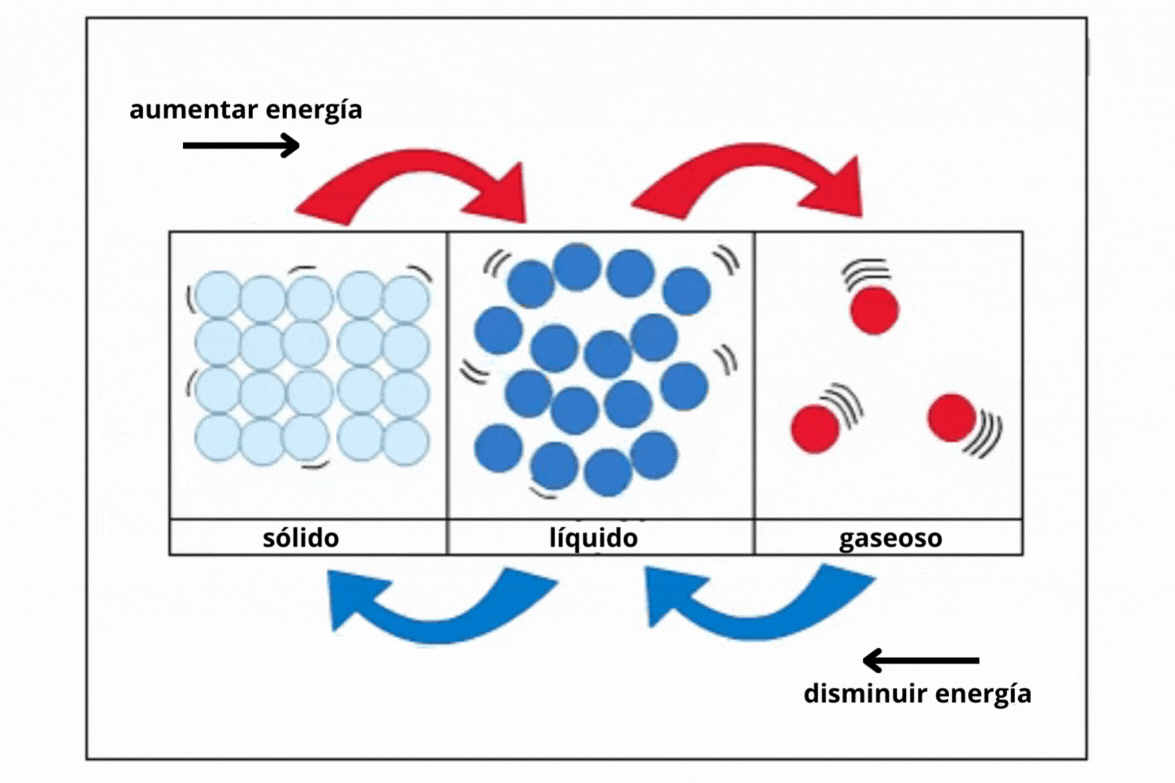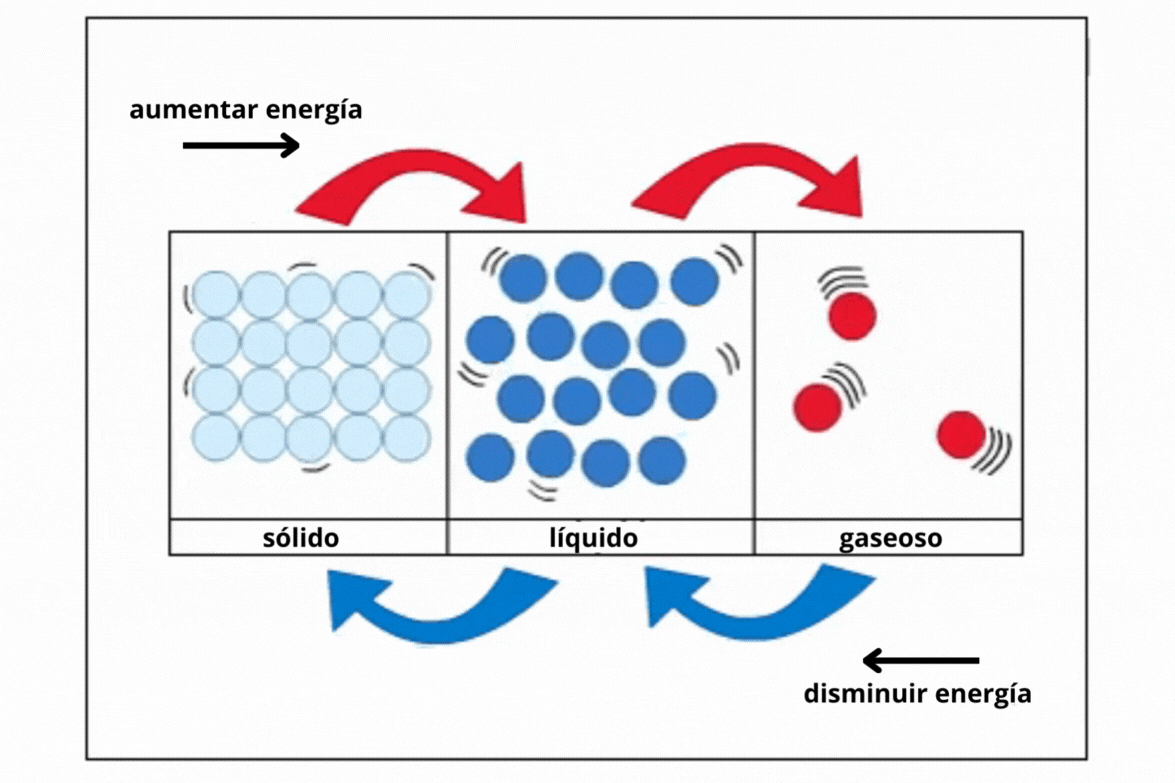
Estado de agregación |