GLOSARIO DE QUÍMICA
GLOSARIO DE QUÍMICA
Especial | A | B | C | D | E | F | G | H | I | J | K | L | M | N | Ñ | O | P | Q | R | S | T | U | V | W | X | Y | Z | TODAS
M |
|---|
Magnitud |
Masa |
Masa molar |
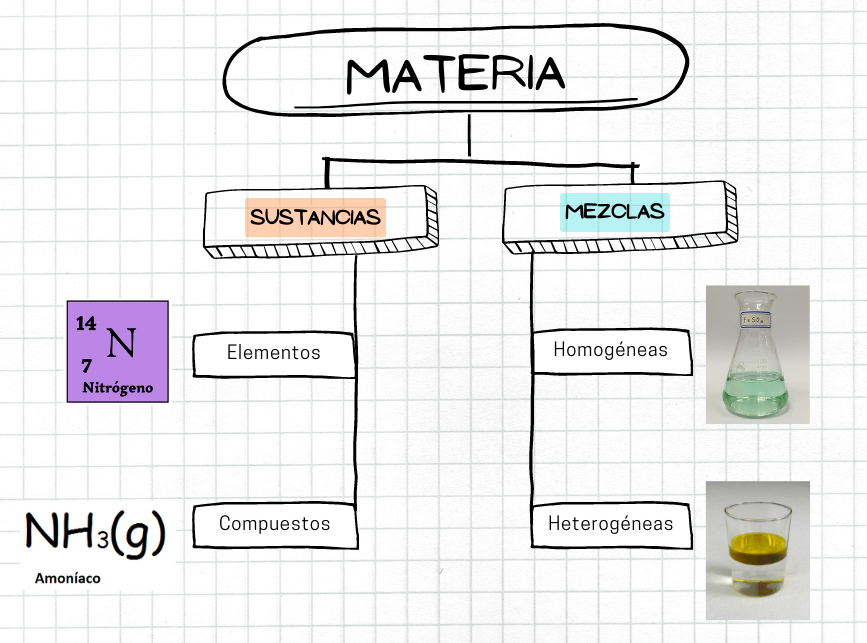
MateriaLa materia es el material físico del universo. La materia es lo que compone todo lo que está a nuestro alrededor. La materia tiene masa y volumen. Hay diferentes tipos de materia. Por ejemplo, algunos tipos de materia son las sustancias, como los elementos y los compuestos. Otro tipo de materia son las mezclas.
|
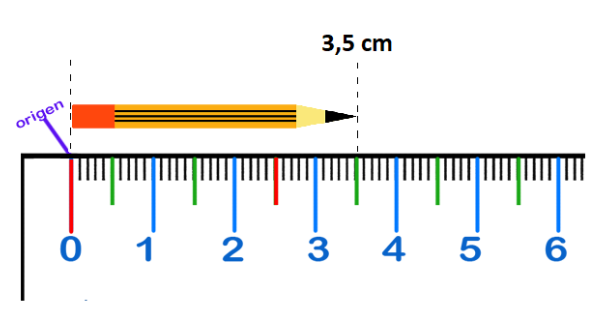
MediciónLa
medición es el proceso de comparar una cantidad desconocida que
queremos determinar con una cantidad conocida de la misma magnitud,
que se usa como referencia o unidad. Al resultado del proceso de medición se le llama medida. |
Medida |
MezclaUna mezcla es un tipo de materia que está formada por dos o más sustancias. En una mezcla, cada sustancia conserva su composición química. Las sustancias tienen composición química fija. En cambio, la composición de una mezcla puede variar. Existen dos tipos de mezclas: las mezclas homogéneas y las mezclas heterogéneas. |
Mezcla Heterogénea |
Mezcla Homogénea |
MolUn mol son 6,02 x 1023 entidades químicas. Estas entidades químicas pueden ser por ejemplo: átomos, moléculas, iones, electrones. El valor 6,02 x 1023 es el número de Avogadro.El mol es la unidad del Sistema Internacional para la cantidad de sustancia (o cantidad química). El mol tiene como símbolo la palabra “mol”. El número de moles de una sustancia es el cociente entre la masa de la sustancia y la masa molar de la sustancia: |
MolalidadLa molalidad es una forma de expresar la concentración de una solución. La molalidad se define como la cantidad química de un soluto contenida en un kilogramo de solvente. La cantidad química debe estar expresada en mol. |
MolaridadLa molaridad es una forma de expresar la concentración de una solución. La molaridad se define como la cantidad química de un soluto contenida en un litro de solución. La cantidad química debe estar expresada en mol. |
MoléculaLa
molécula es la unión de dos o más átomos. La unión de los átomos
en
las moléculas se da por enlaces
químicos. Los átomos que forman la molécula pueden ser del mismo elemento químico o de distintos elementos químicos. Las moléculas tienen propiedades físicas y químicas que las caracterizan. Un ejemplo de molécula es la molécula de agua. Su fórmula química es H2O. Está compuesta por un átomo de oxígeno y dos átomos de hidrógeno unidos por enlaces covalentes. |
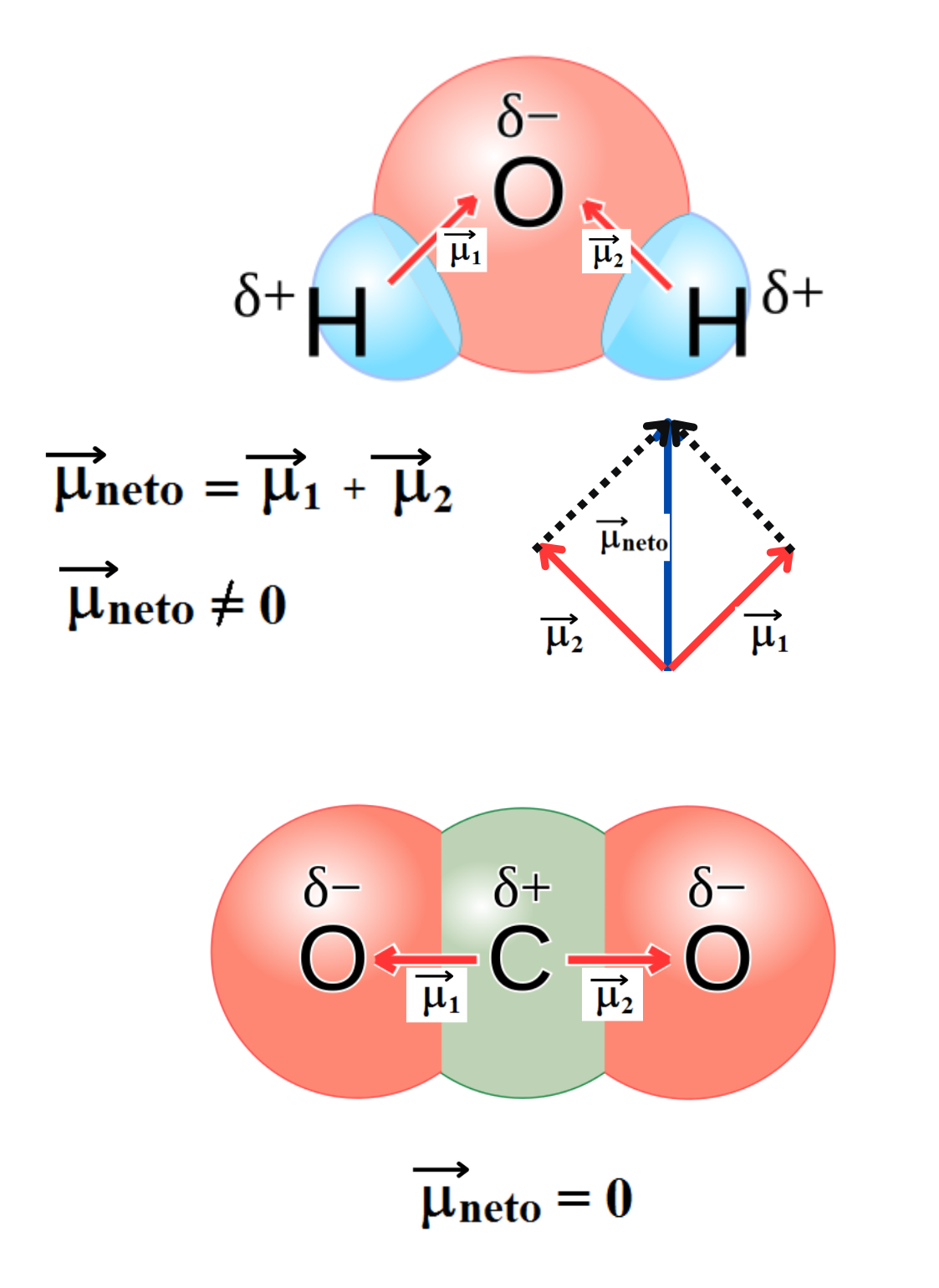
Molécula ApolarUna molécula es apolar si su momento dipolar neto es igual a cero. Las moléculas que no presentan regiones con cargas parciales son apolares (Ejemplo: molécula de oxígeno). Las moléculas que tienen enlaces polares son apolares cuando el momento dipolar neto es cero (Ejemplo: molécula de dióxido de carbono). |
Molécula Polar |
Momento DipolarEl momento dipolar se define como el producto entre las cargas y la distancia entre dichas cargas. El momento dipolar es una magnitud vectorial. NOTA: En química es común representar el momento dipolar con un vector (flecha) que apunta desde la carga parcial positiva hacia la carga parcial negativa. En la convención moderna y en física, el vector apunta hacia la carga parcial positiva. El momento dipolar en un enlace aumenta con la diferencia de electronegatividad de los átomos que forman el enlace.
|