GLOSARIO DE QUÍMICA
GLOSARIO DE QUÍMICA
| All categories |
ESTRUCTURA DE LA MATERIA |
|---|
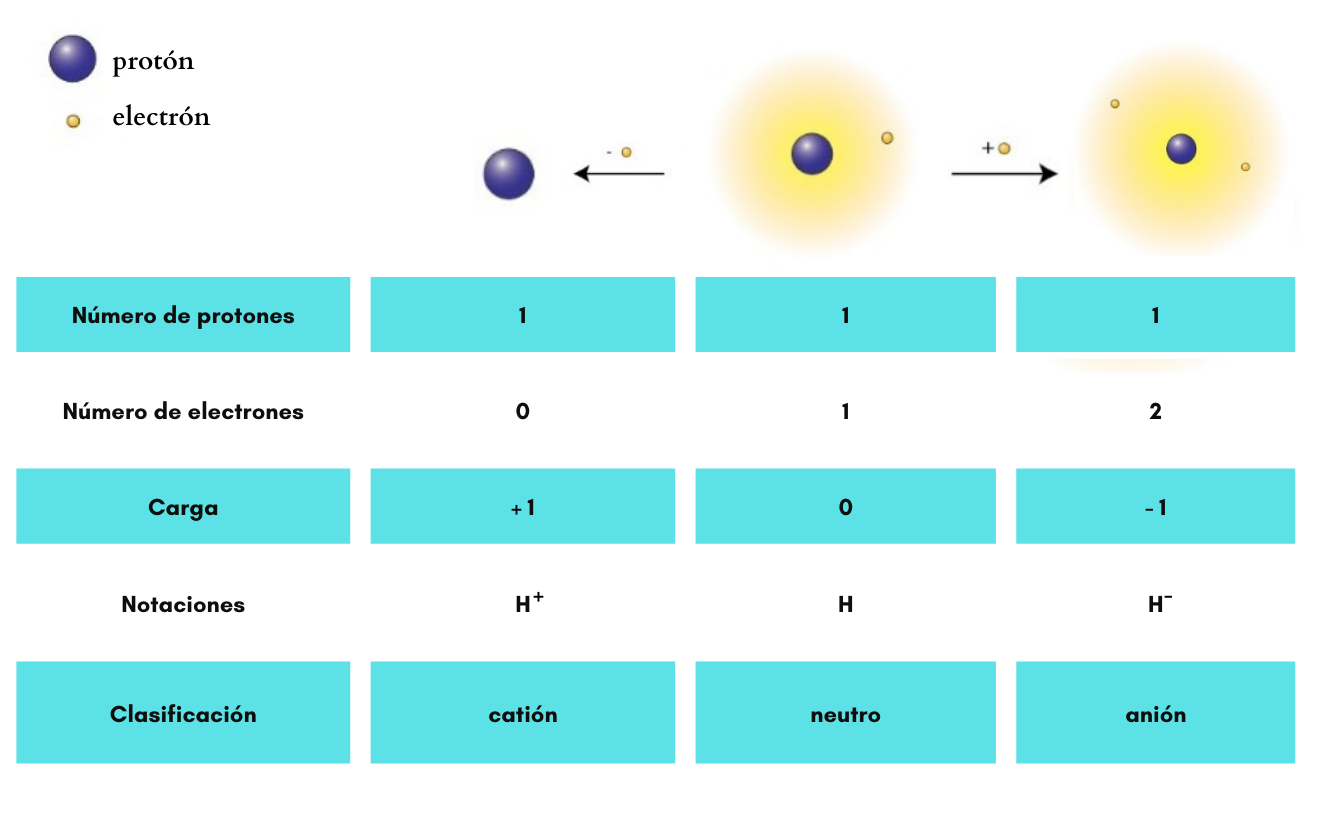
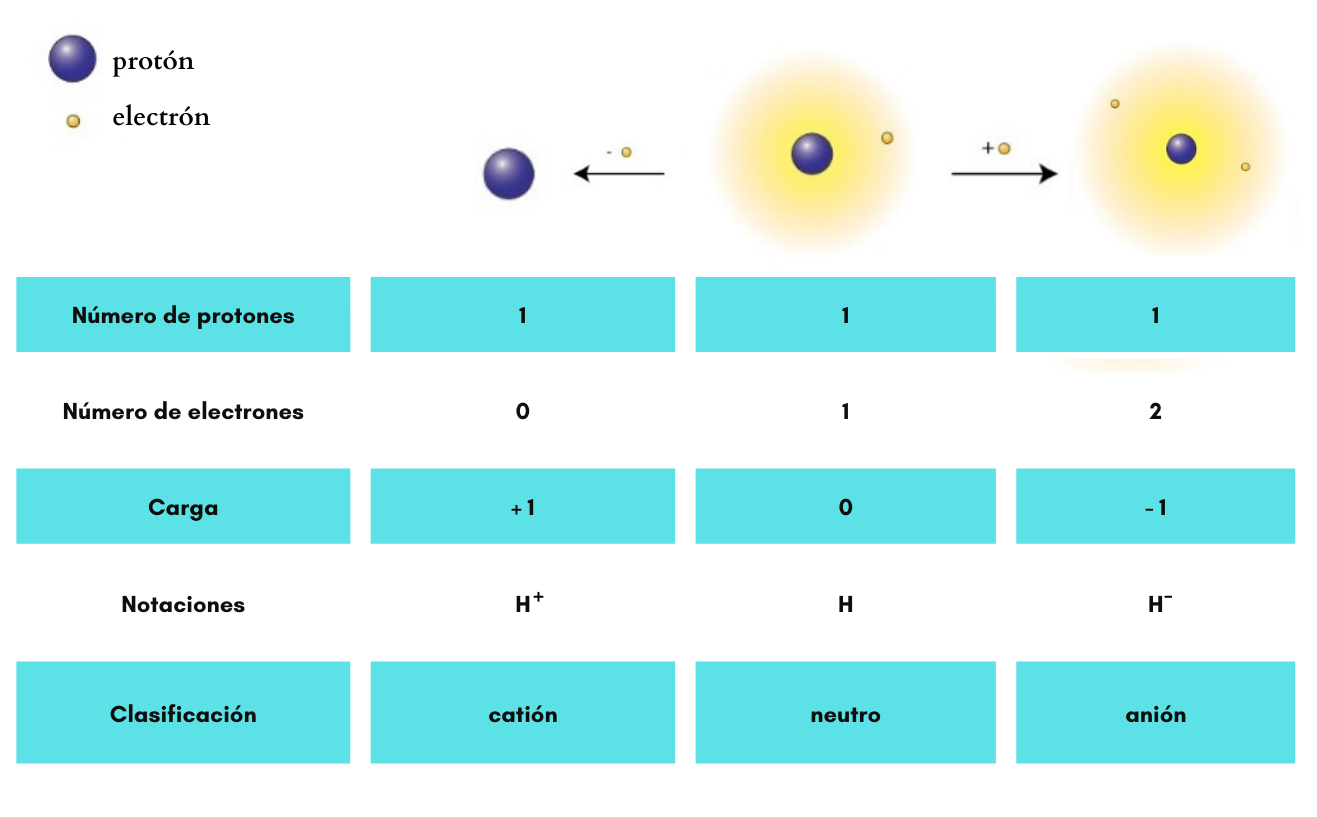
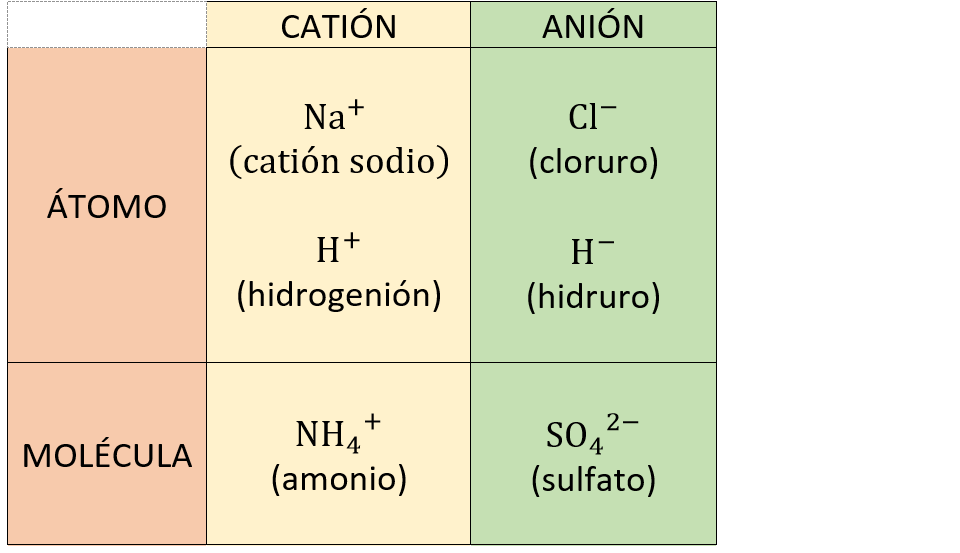
AniónUn
anión es un ion
con
carga eléctrica negativa. Ejemplos: Ejemplos: Cl- (cloruro), SO42- (sulfato), H- (anión hidruro)
|
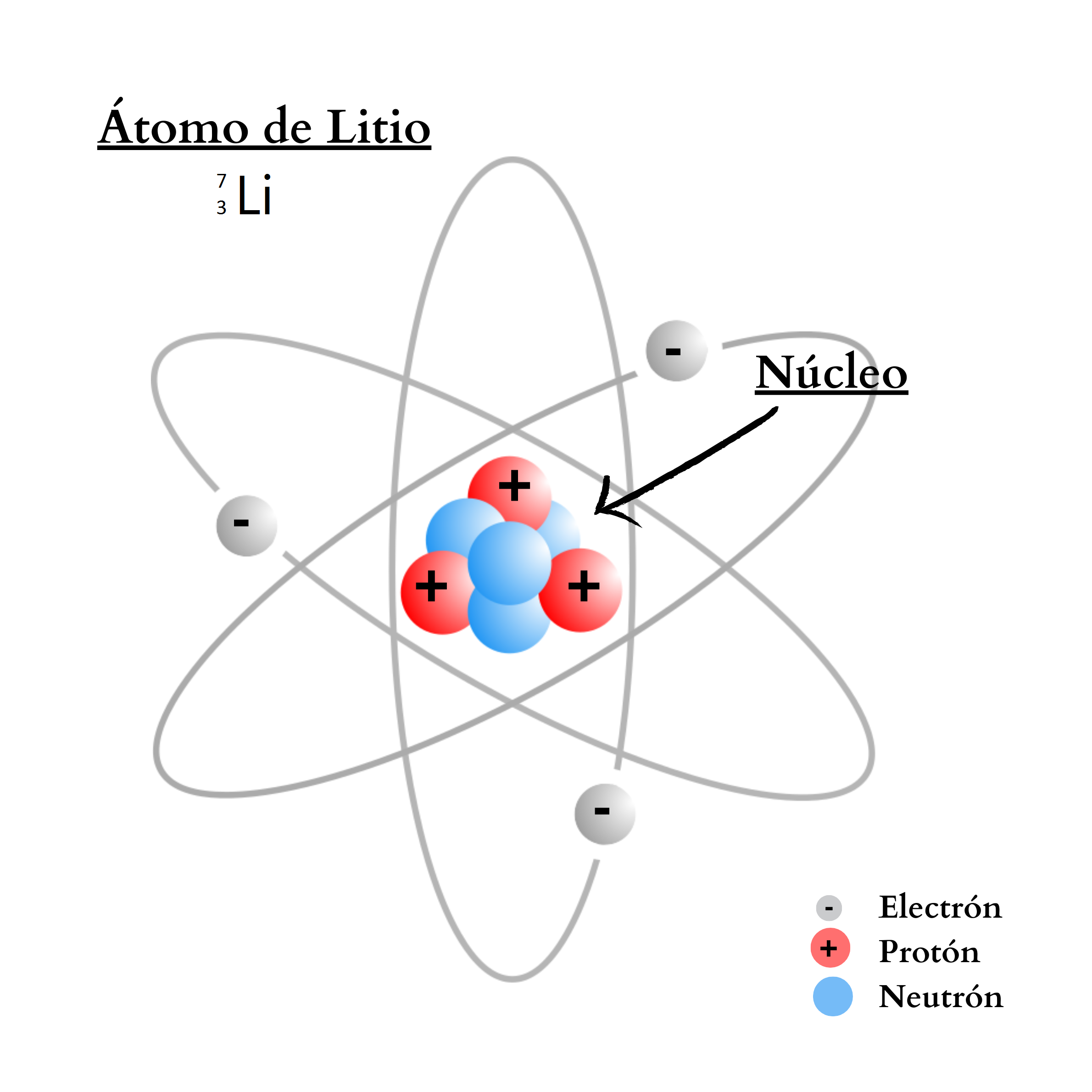
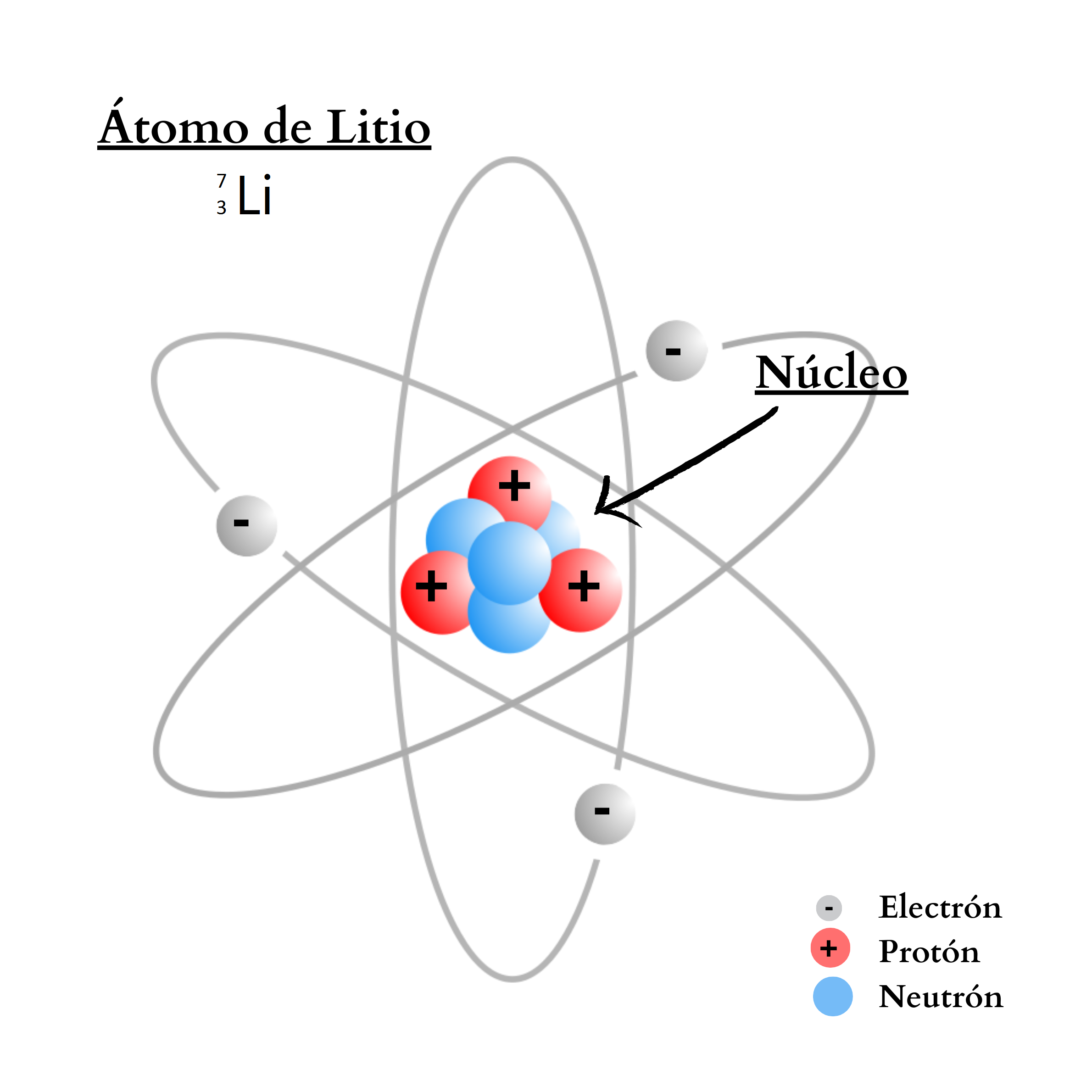
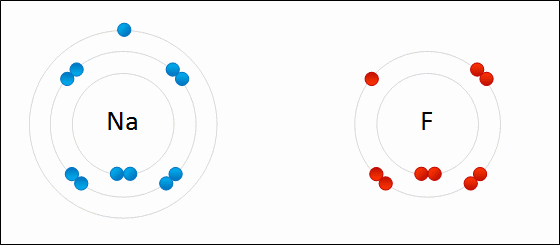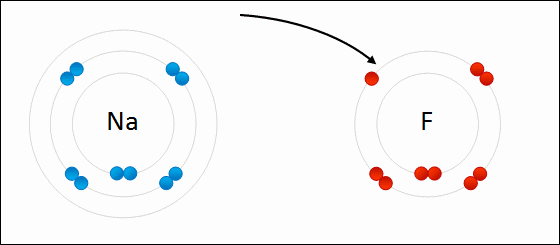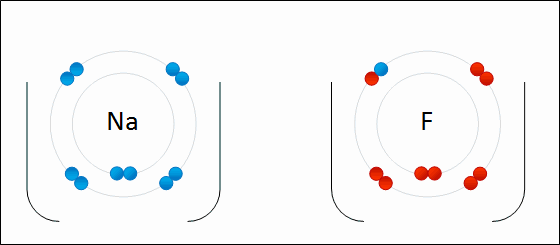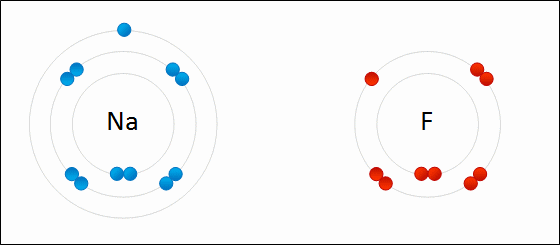
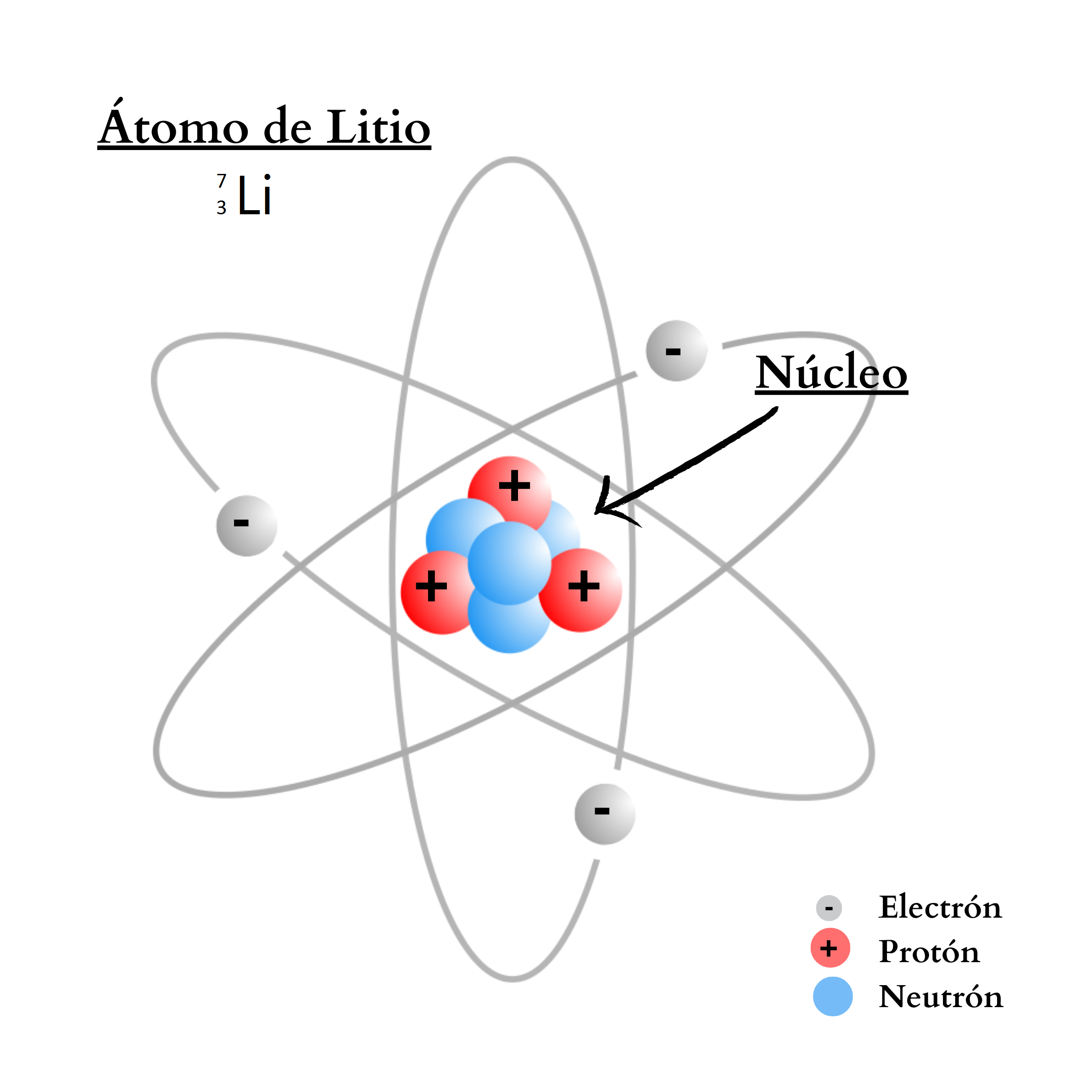
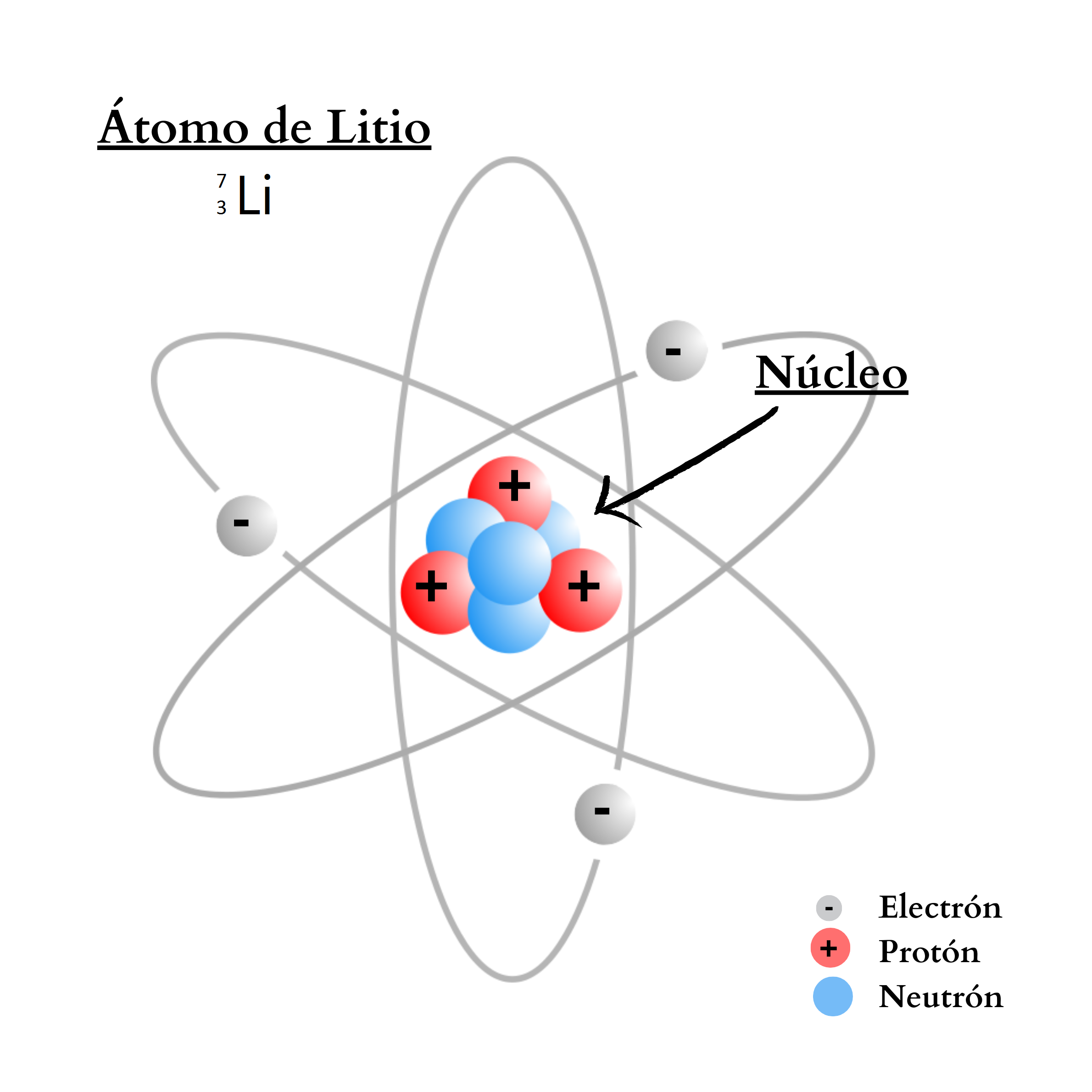
ÁtomoEl átomo es la mínima unidad de la materia que mantiene las propiedades de un elemento químico Un átomo está compuesto por un núcleo y una periferia. En el núcleo del átomo se encuentran los protones y los neutrones. En la periferia se encuentran los electrones. Cada elemento químico se compone de una sola clase de átomos. Cada elemento químico se representa con un símbolo químico formado por una letra o por dos letras. Por ejemplo, el elemento nitrógeno se representa como N, y el elemento calcio como Ca.
|
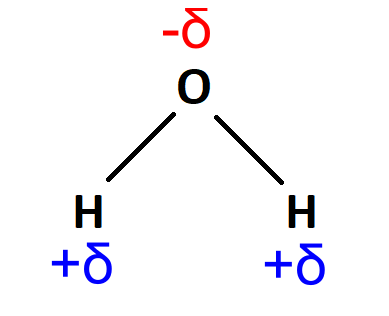
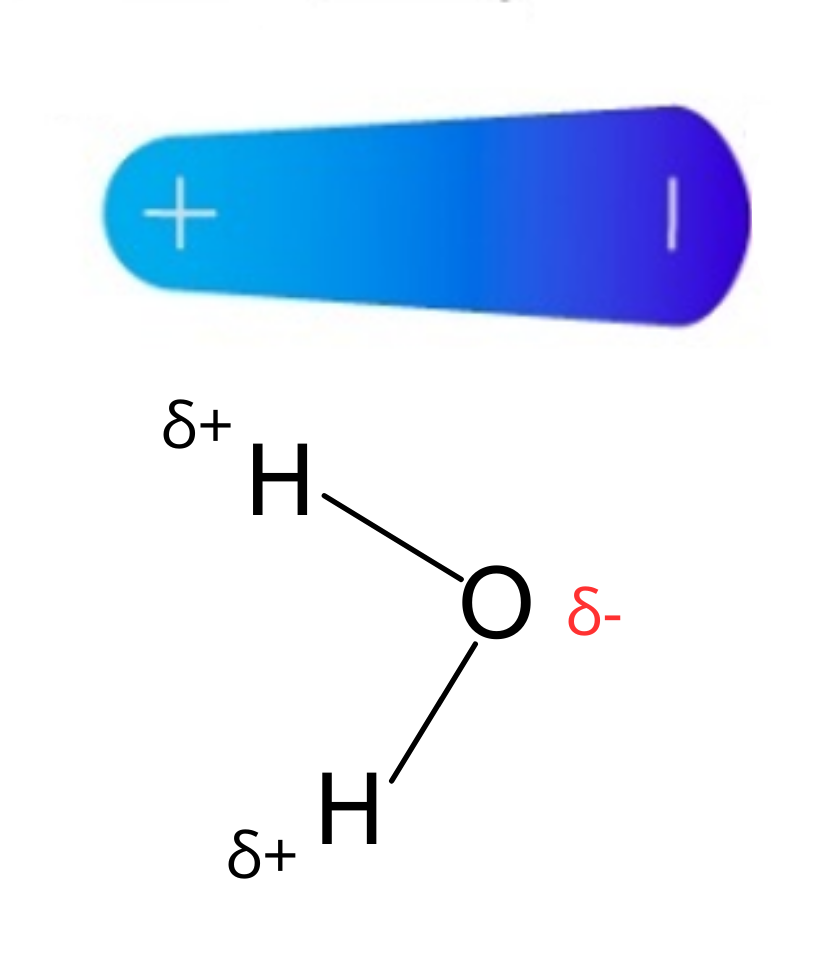
Carga parcialUna carga parcial es una carga eléctrica sobre un átomo. La carga parcial tiene un valor menor a la unidad de carga (1). Las cargas parciales aparecen entre átomos de elementos que tienen diferentes electronegatividades. Las cargas parciales se representan con la letra griega delta (δ) con un signo que indica la carga negativa o positiva: δ− o δ+
|
CatiónUn
catión es un ion
con
carga eléctrica positiva. Ejemplos:
|
Composición QuímicaLa
composición química de una sustancia
es
el tipo y cantidad de cada elemento
dentro
de la sustancia. Por ejemplo, la sustancia agua está compuesta por los elementos hidrógeno y oxígeno. En cada molécula de agua, por cada átomo de oxígeno (O) hay 2 átomos de hidrógeno (H). Si se modifica la composición química de una sustancia se transforma en una nueva sustancia.
|
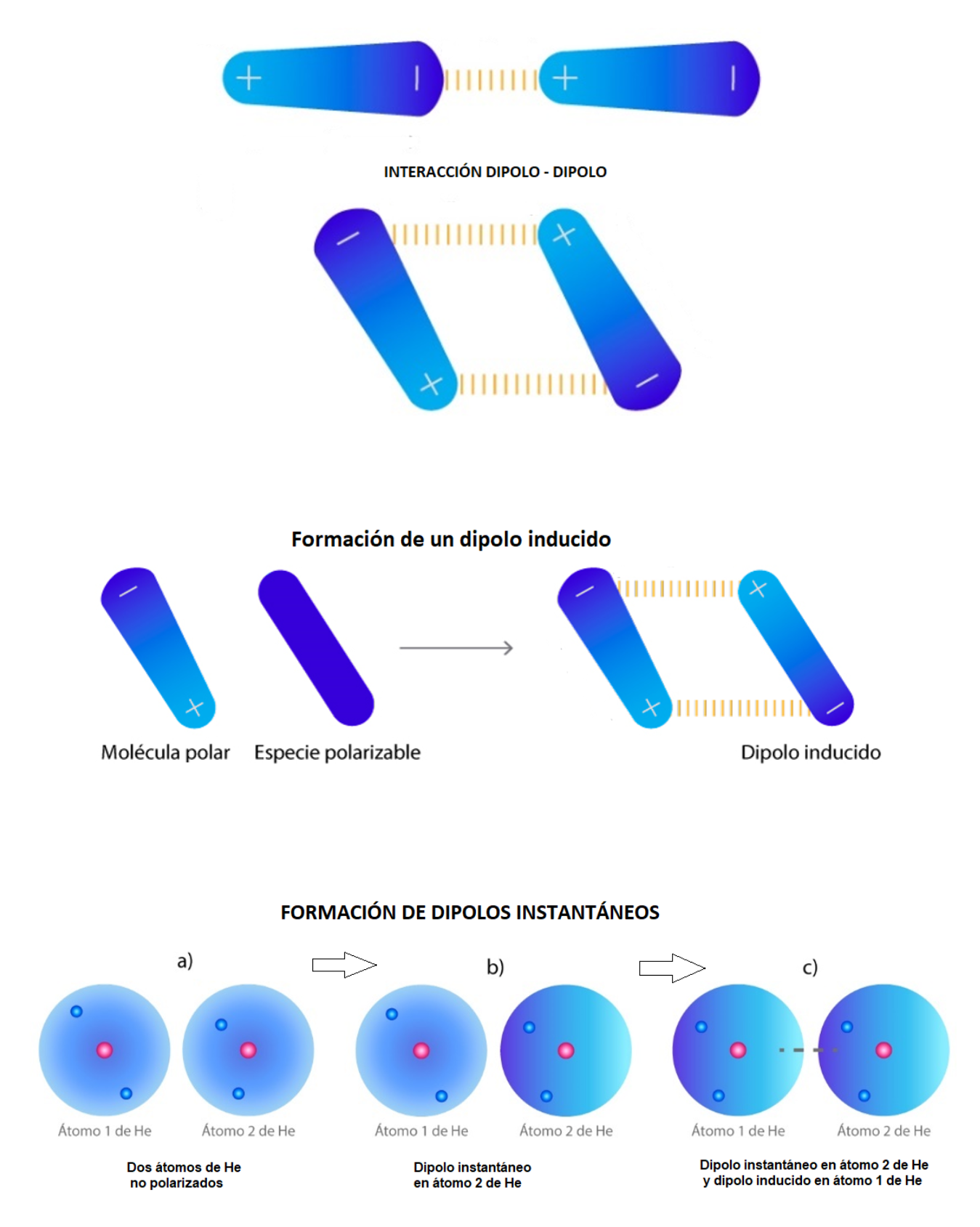
DipoloUn dipolo es un sistema formado por dos cargas opuestas (una de las cargas es positiva y la otra carga es negativa). Las cargas se encuentran cercanas. En una molécula se forma un dipolo cuando una región de la molécula tiene carga parcial positiva y otra región de la molécula tiene carga parcial negativa.
|
Electrón |
Elemento Químico
El elemento químico es una sustancia que no se puede descomponer en otra sustancia más simple. Cada elemento químico se representa con un símbolo químico formado por una letra o por dos letras. Por ejemplo, el elemento nitrógeno se representa como N, y el elemento calcio como Ca. Todos los elementos conocidos se ordenan en la Tabla Periódica. Todos los átomos de un mismo elemento tienen la misma cantidad de protones.
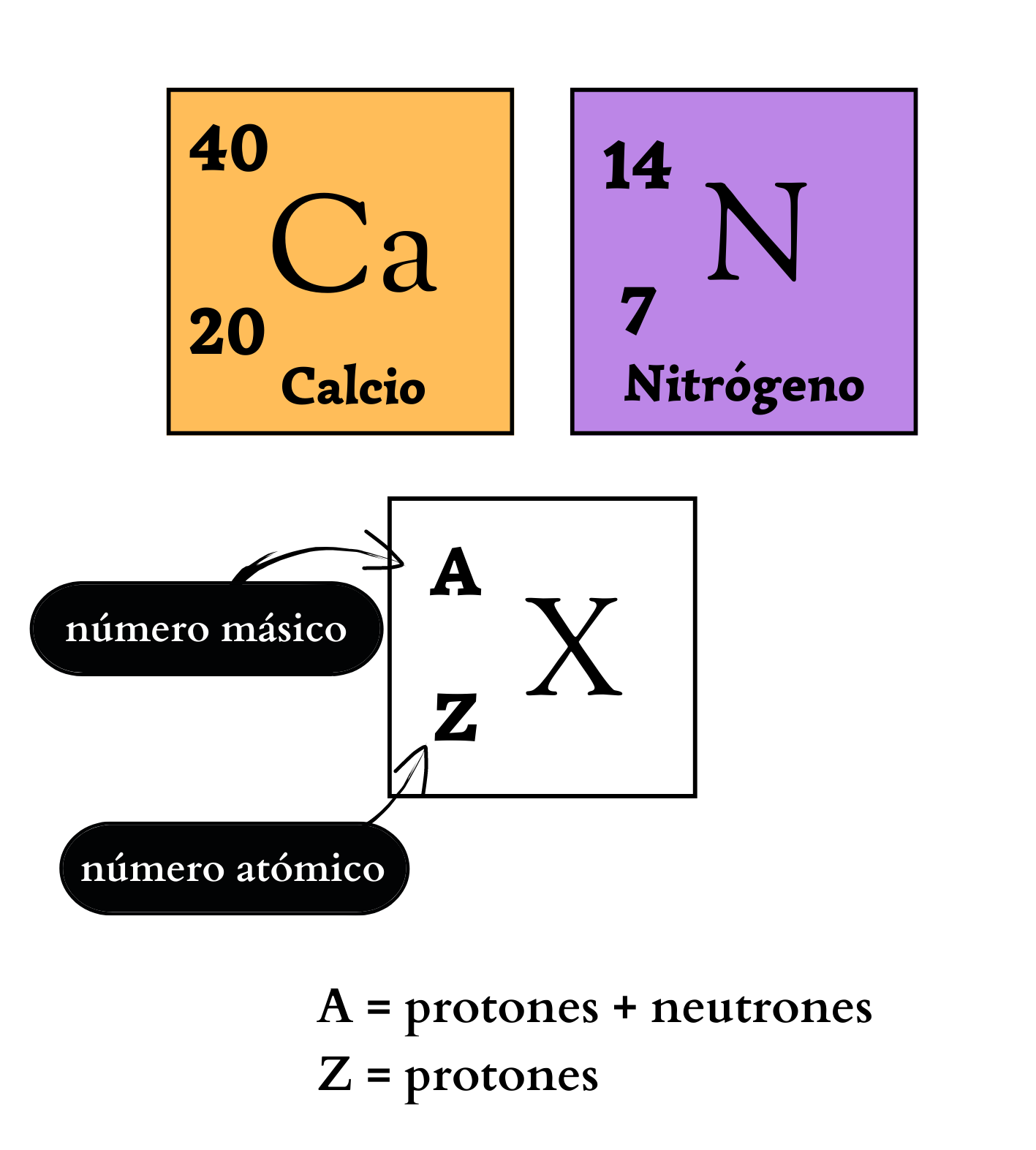
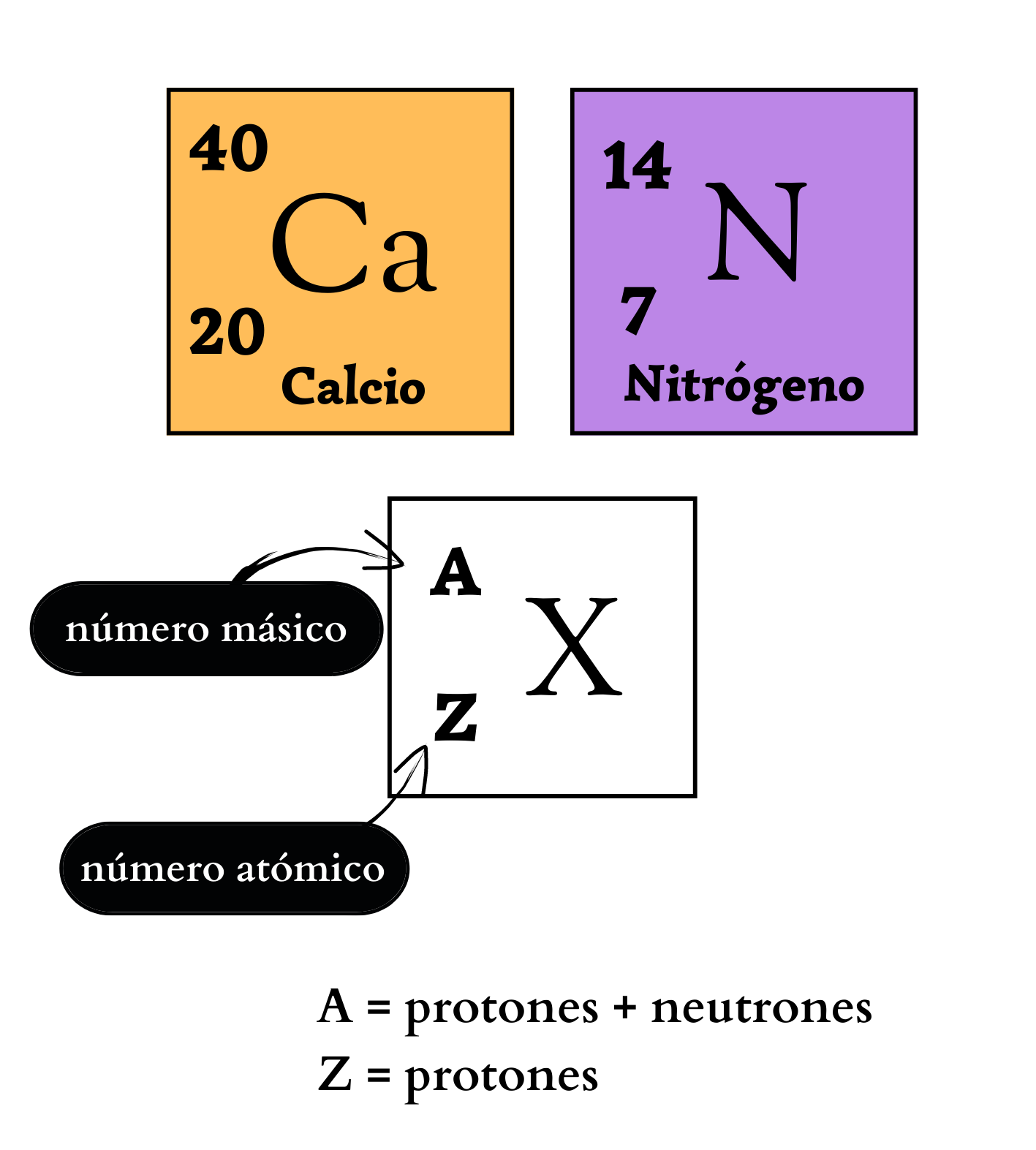
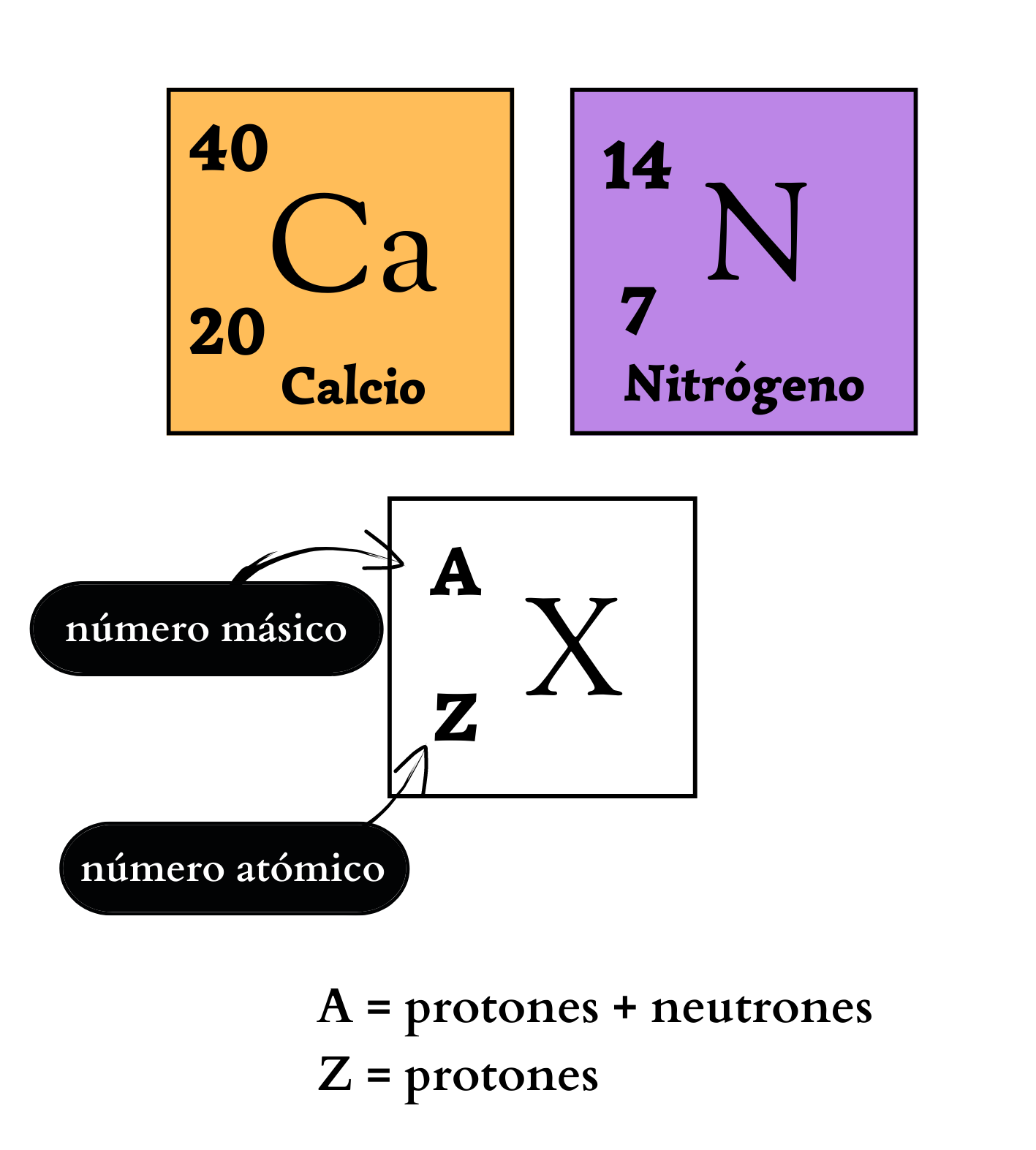
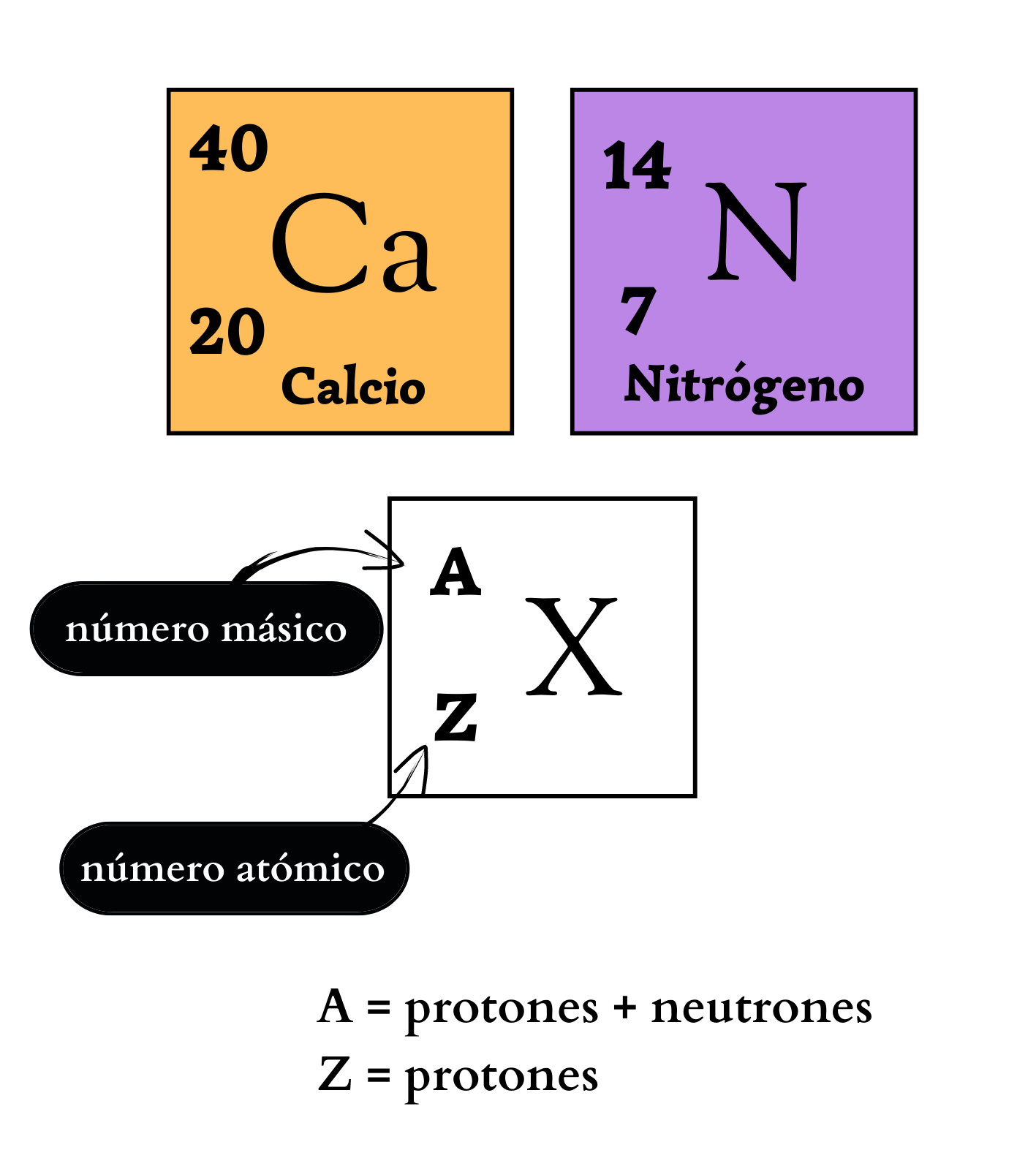
Elemento químico Representación de un elemento en la tabla periódica. De forma genérica, con la letra equis mayúscula hay un símbolo químico de un elemento. Arriba a la izquierda, como superíndice, la letra a mayúscula representa el número másico, que indica la cantidad de protones más la cantidad de neutrones. Abajo a la izquierda, como subíndice, la letra mayúscula zeta representa la cantidad de protones. Ejemplos Como ejemplos se indican: El elemento calcio, C mayúscula, a minúscula, número másico 40, y número atómico 20. Y el elemento nitrógeno, ene mayúscula, número másico 14, y número atómico 7. |
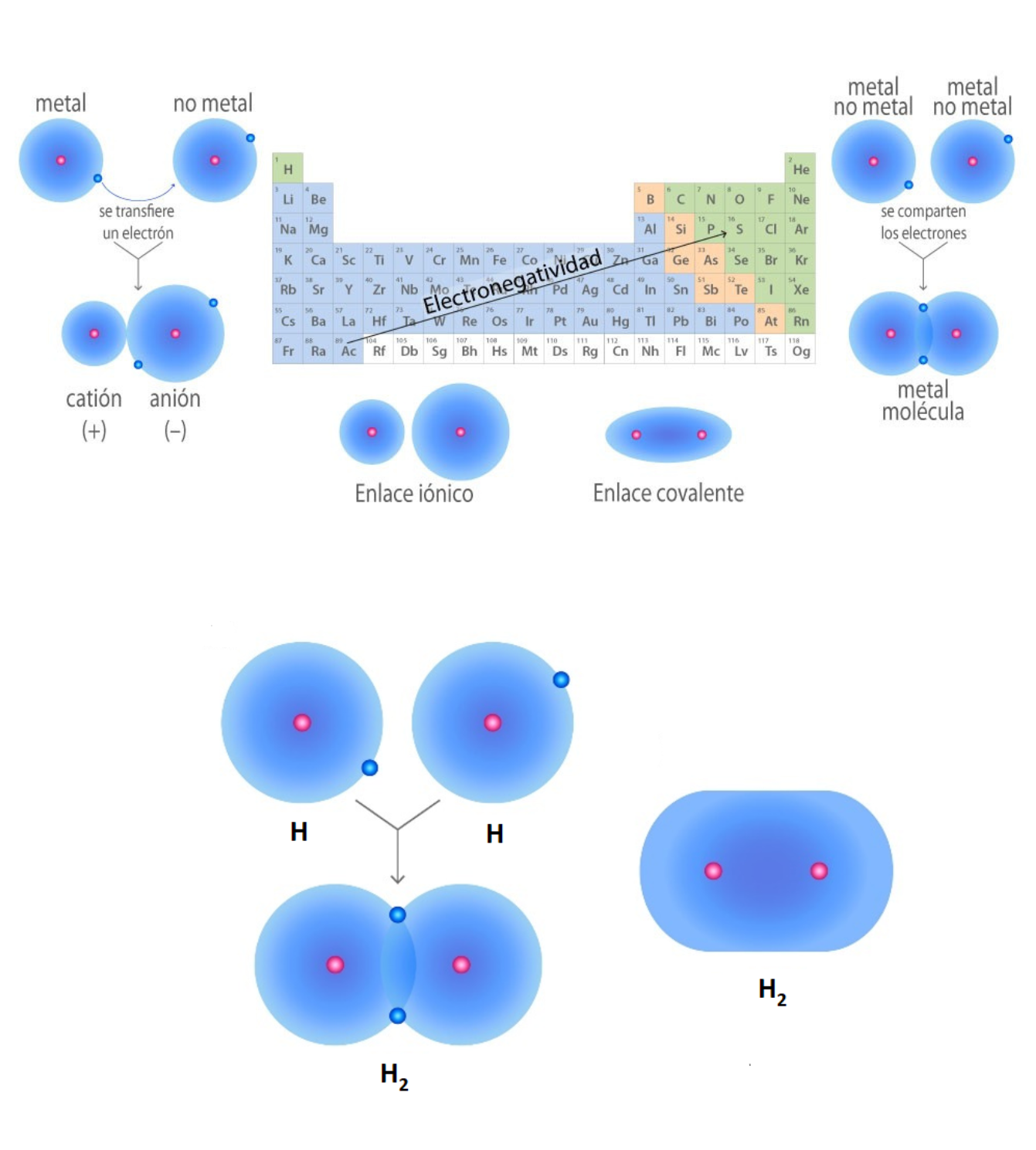
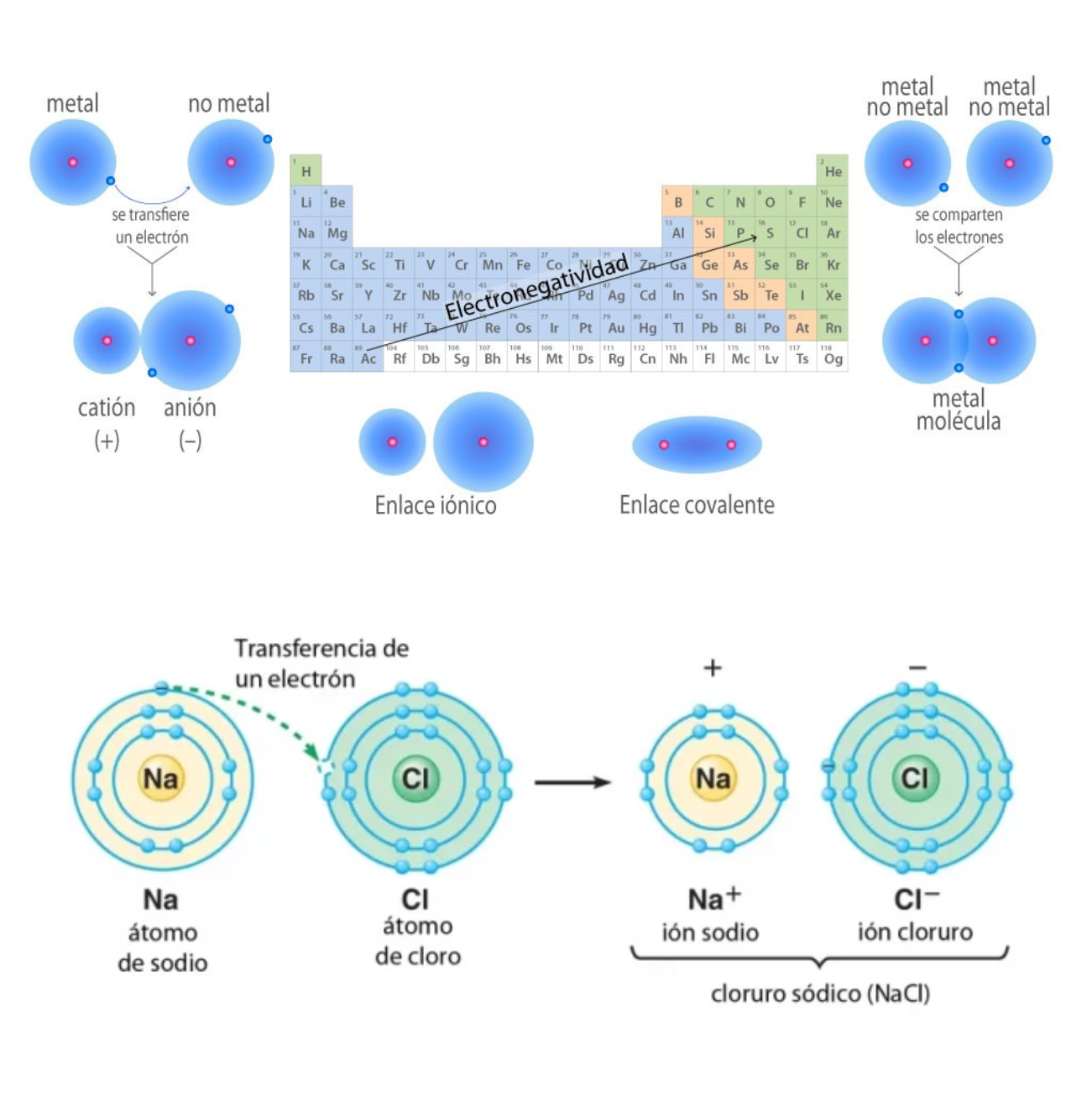
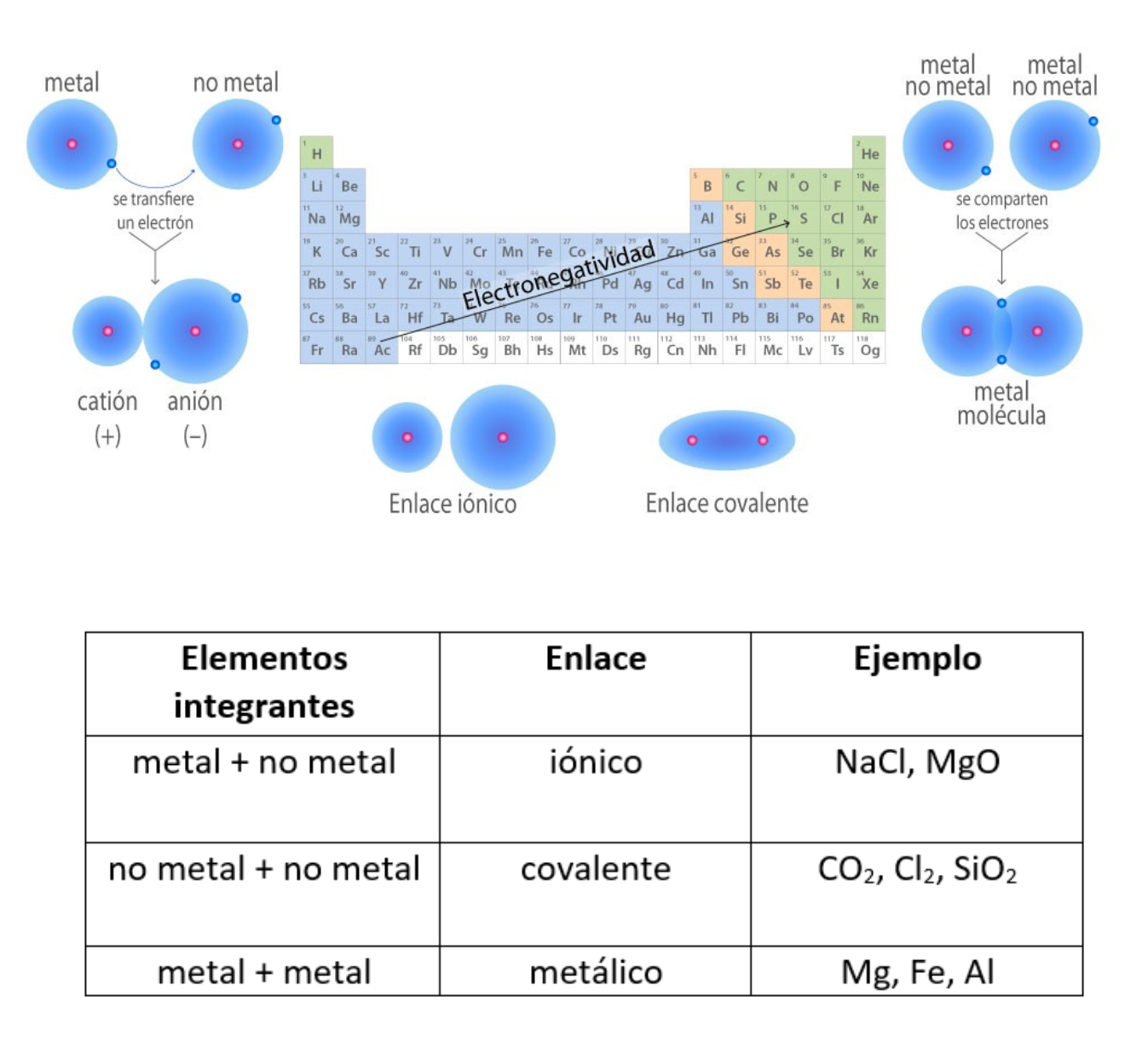
Enlace CovalenteEl
enlace covalente es un enlace
químico
formado
entre dos átomos
que
comparten electrones. La diferencia de electronegatividad entre los átomos que se enlazan puede ser de nula a intermedia. Se llama enlace covalente no polar cuando los electrones del enlace se comparten por igual entre los átomos. En este caso la diferencia de electronegatividad es nula. Se llama enlace covalente polar cuando los electrones del enlace no se comparten por igual entre los átomos. En este caso la diferencia de electronegatividad es intermedia.
|
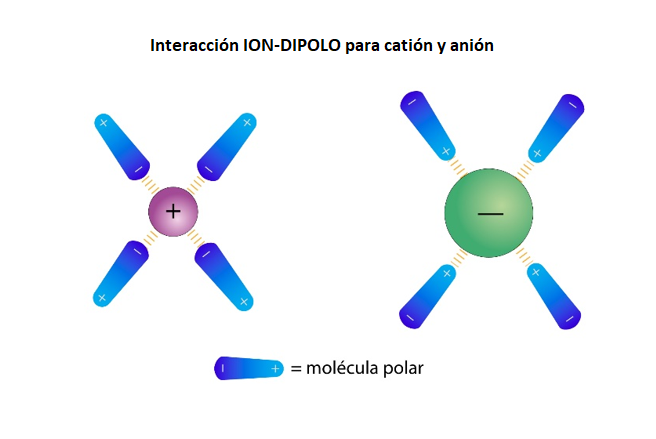
Enlace Ion-Dipolo |
Enlace IónicoEl
enlace iónico es el enlace que mantiene unido a los cationes y
aniones en las sustancias
iónicas. Un enlace iónico es la atracción electrostática entre las cargas eléctricas de cationes y aniones. Los cationes y aniones se forman a partir de átomos con una diferencia de electronegatividad muy grande.
|
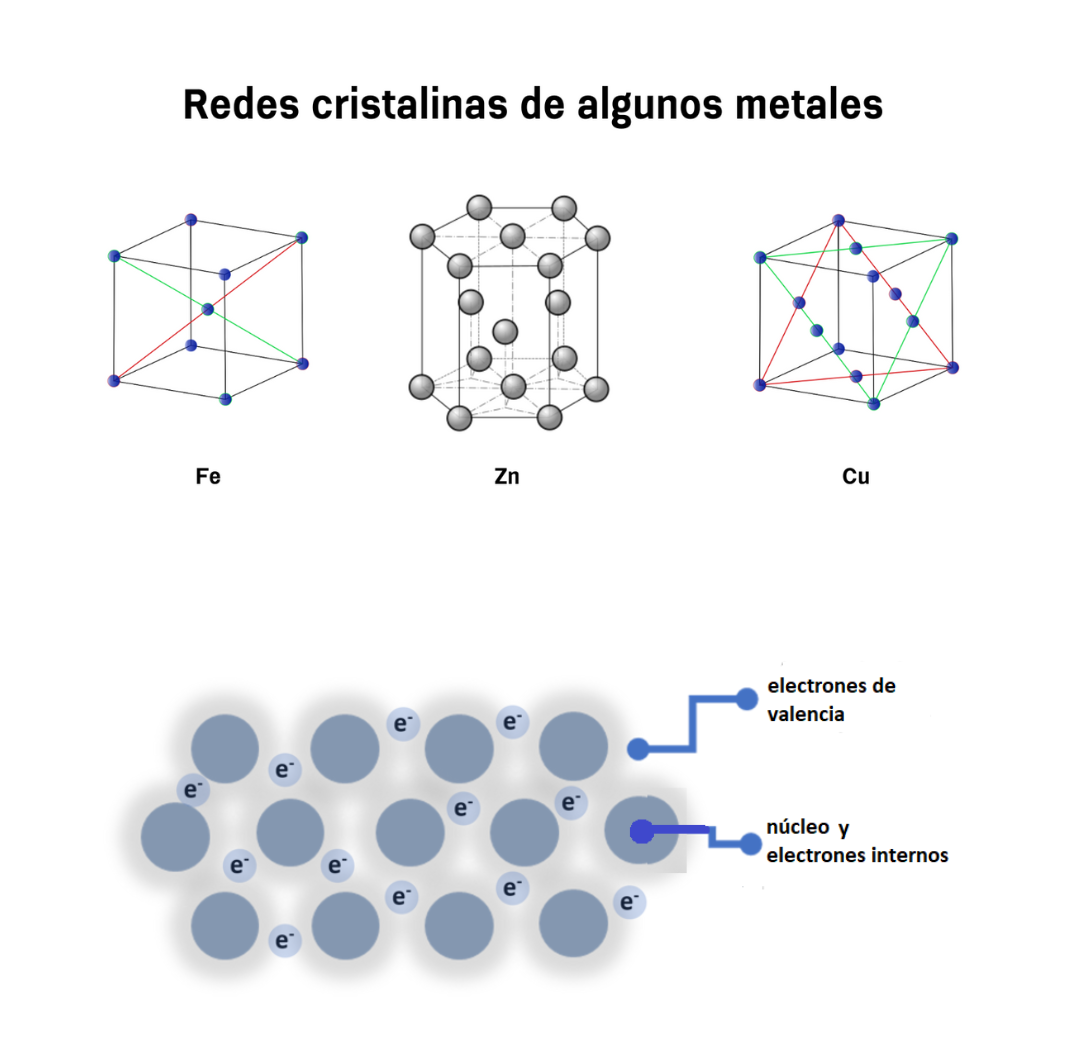
Enlace MetálicoEl enlace metálico es un enlace químico que mantiene unidos a los átomos de los metales. En el enlace metálico los núcleos y los electrones internos de los átomos se encuentran ordenados en una red cristalina. Los electrones de valencia de esos átomos se mueven de forma libre a lo largo de todo el metal. Los electrones de valencia se comparten entre todos los átomos del metal. Los electrones de valencia del metal están deslocalizados. El enlace metálico genera características en los metales. Los metales:
|
Enlace Químico (Unión Química)El
enlace químico es la fuerza que une átomos,
moléculas
o
iones
entre
sí. Los enlaces químicos generan grupos de átomos, moléculas o iones unidos entre sí de forma estable. Por ejemplo, el enlace que existe entre 2 átomos de hidrógeno (H) forma la molécula de dihidrógeno (H2). Tipos de enlaces:
|
Enlaces de Baja EnergíaSon
enlaces
químicos
que
poseen baja energía
de enlace
y
actúan a distancias muy cortas. Los enlaces de baja energía tienen menor energía que los enlaces:
Existen diferentes tipos de enlaces de baja energía:
|
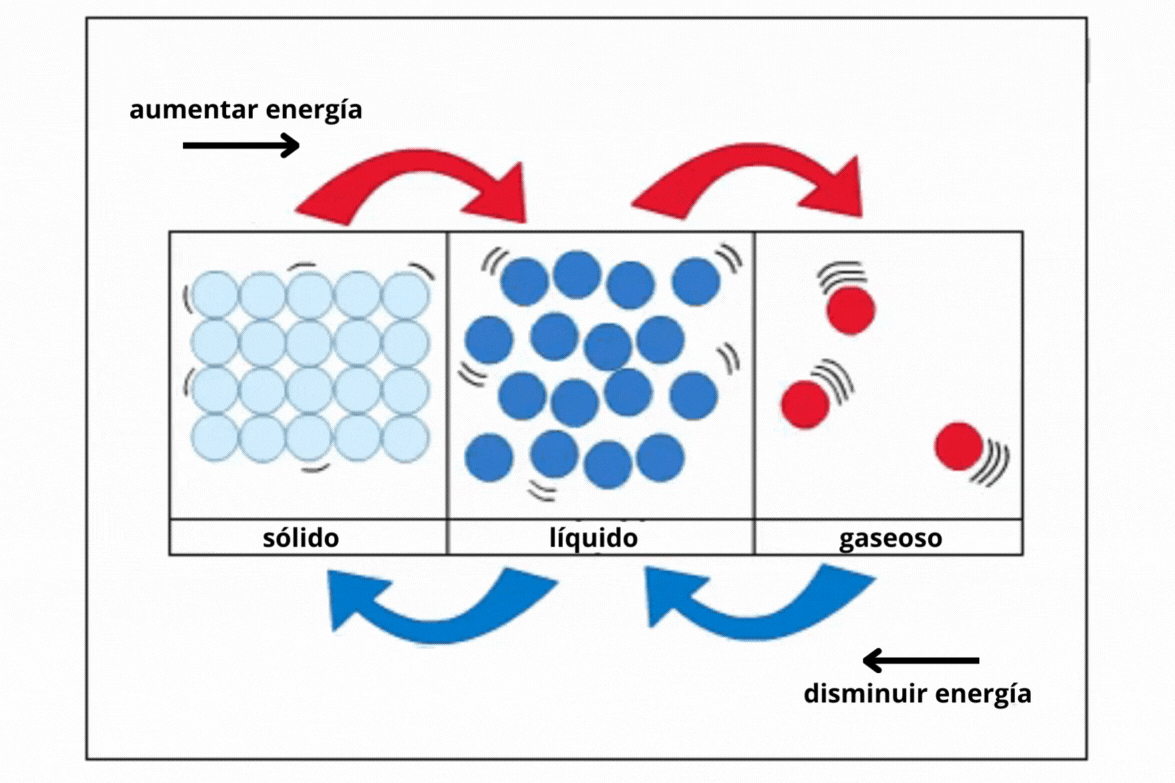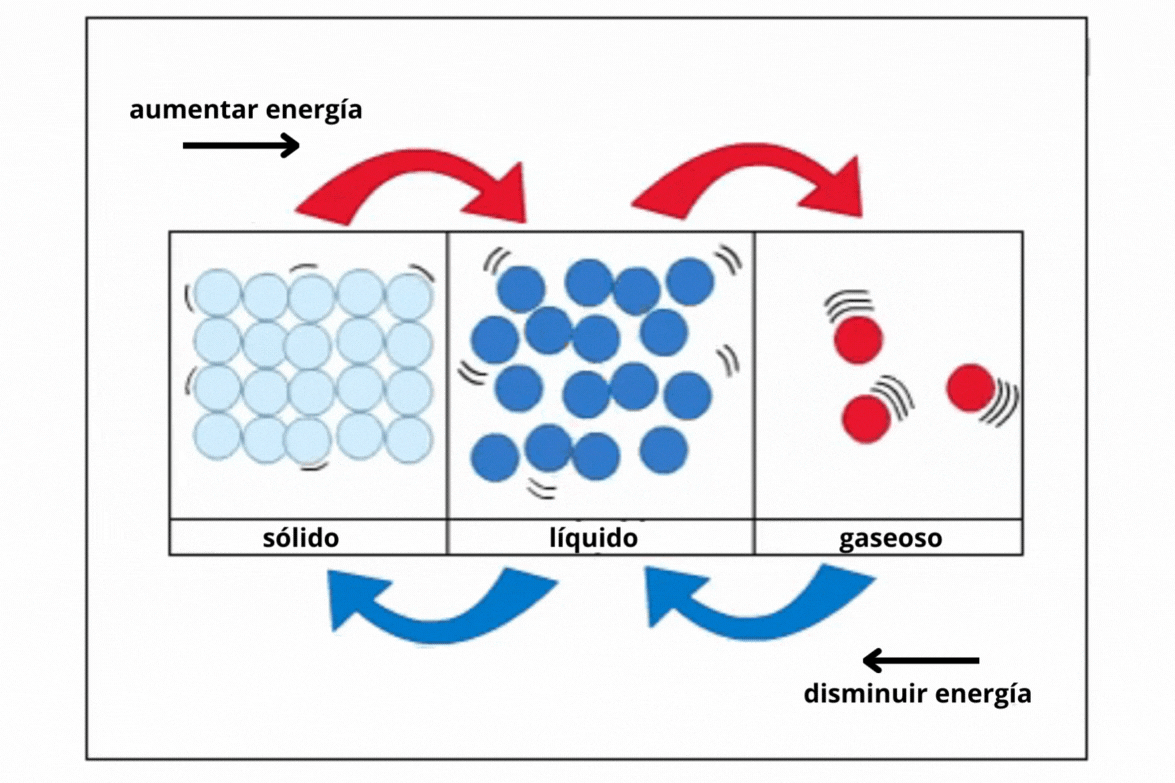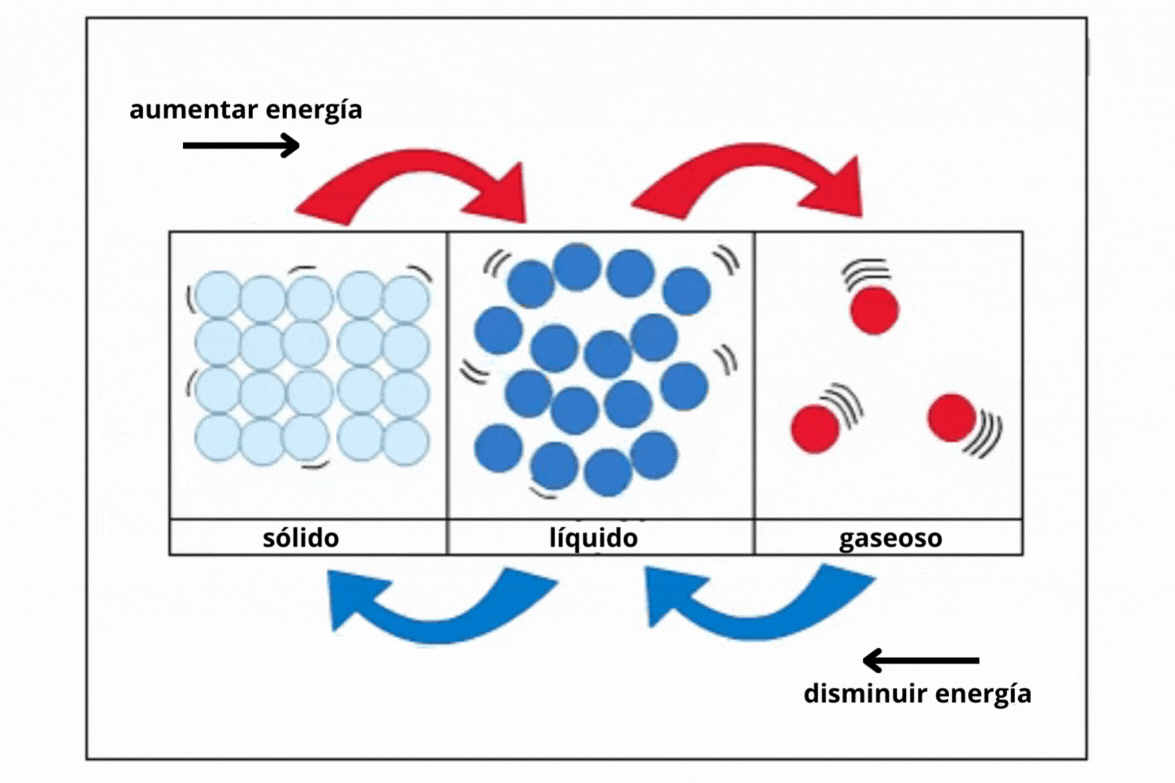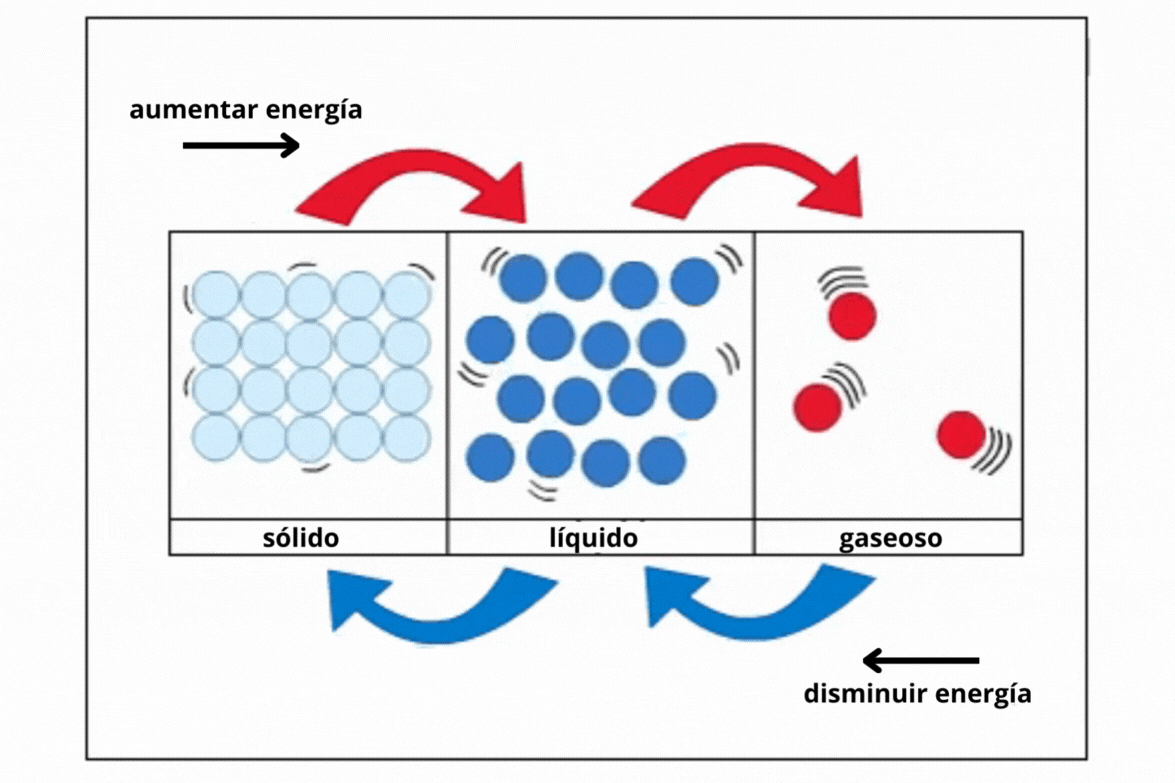
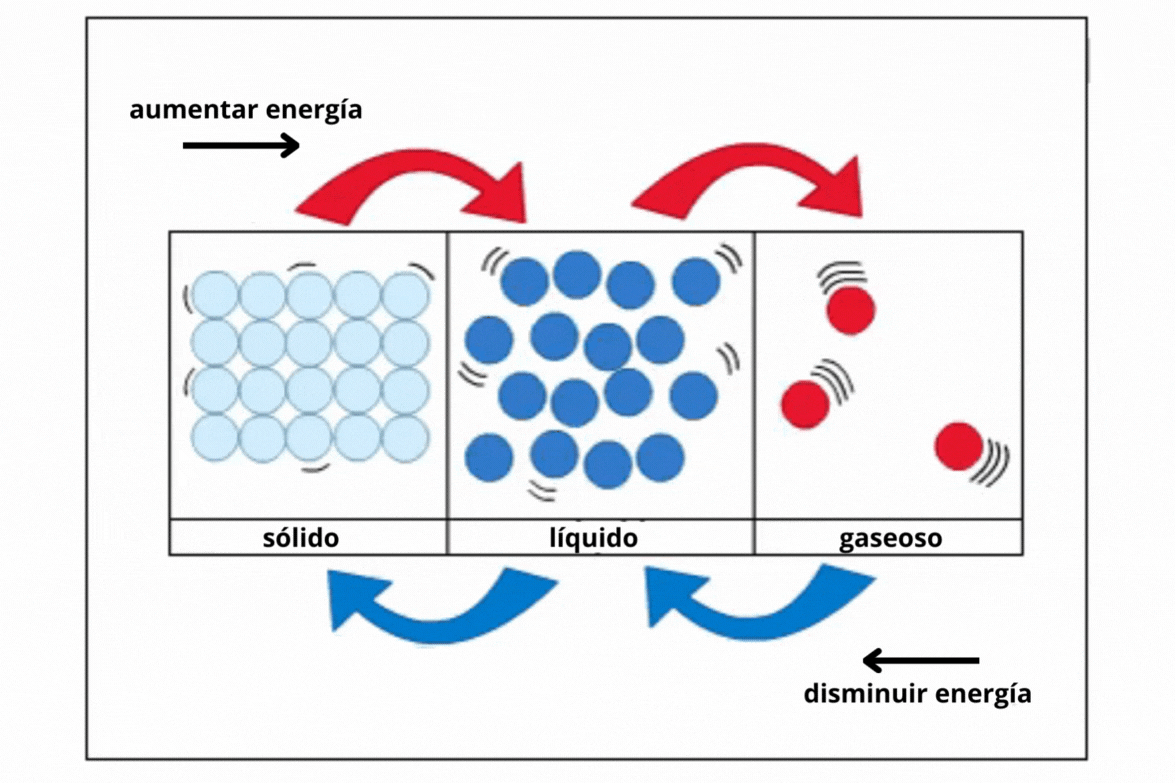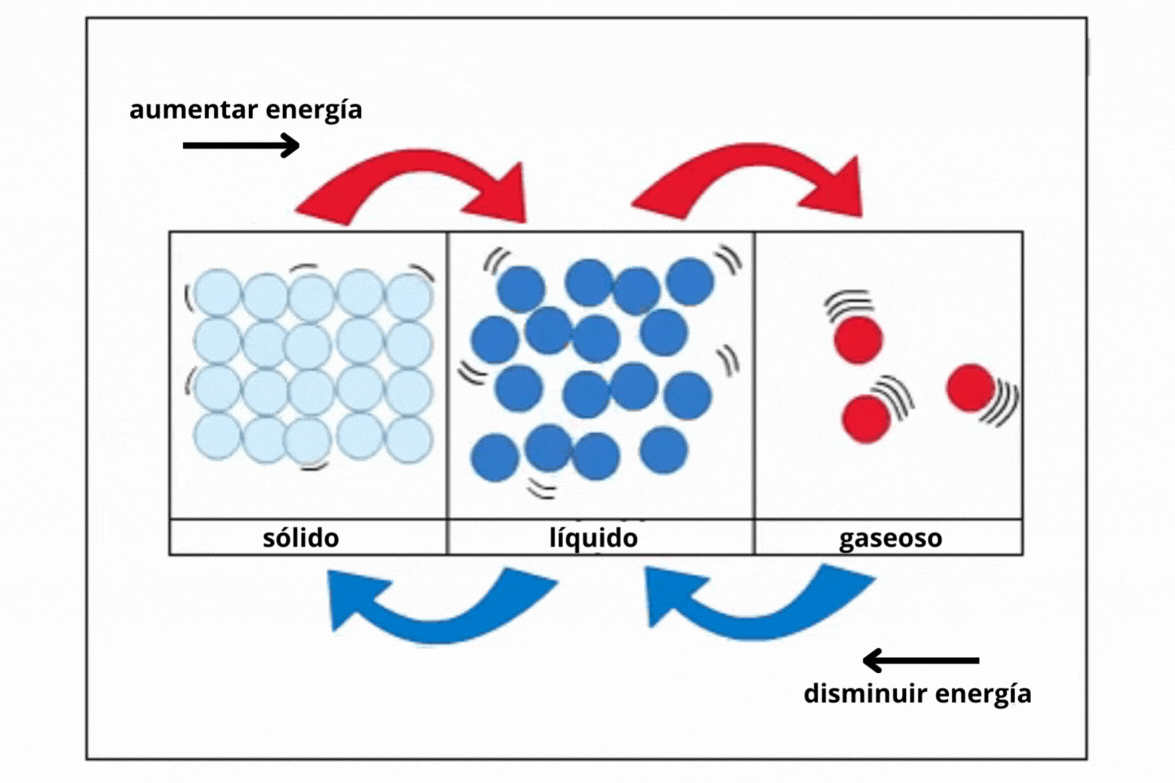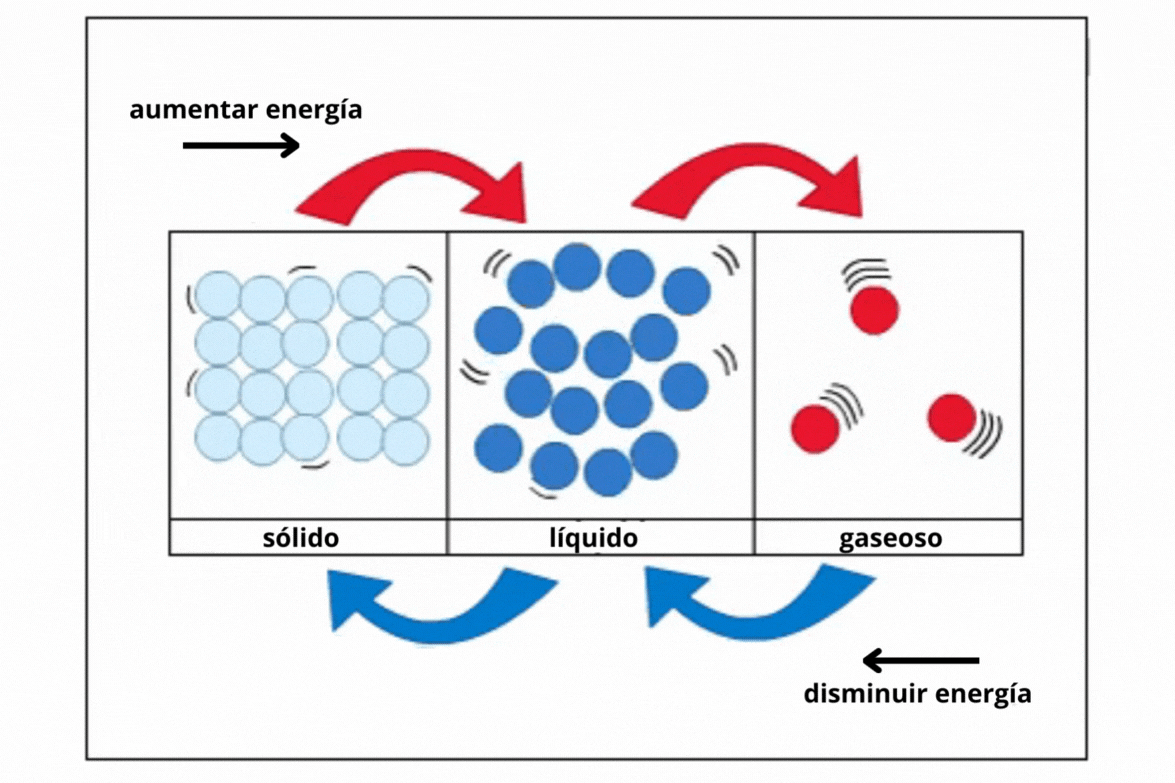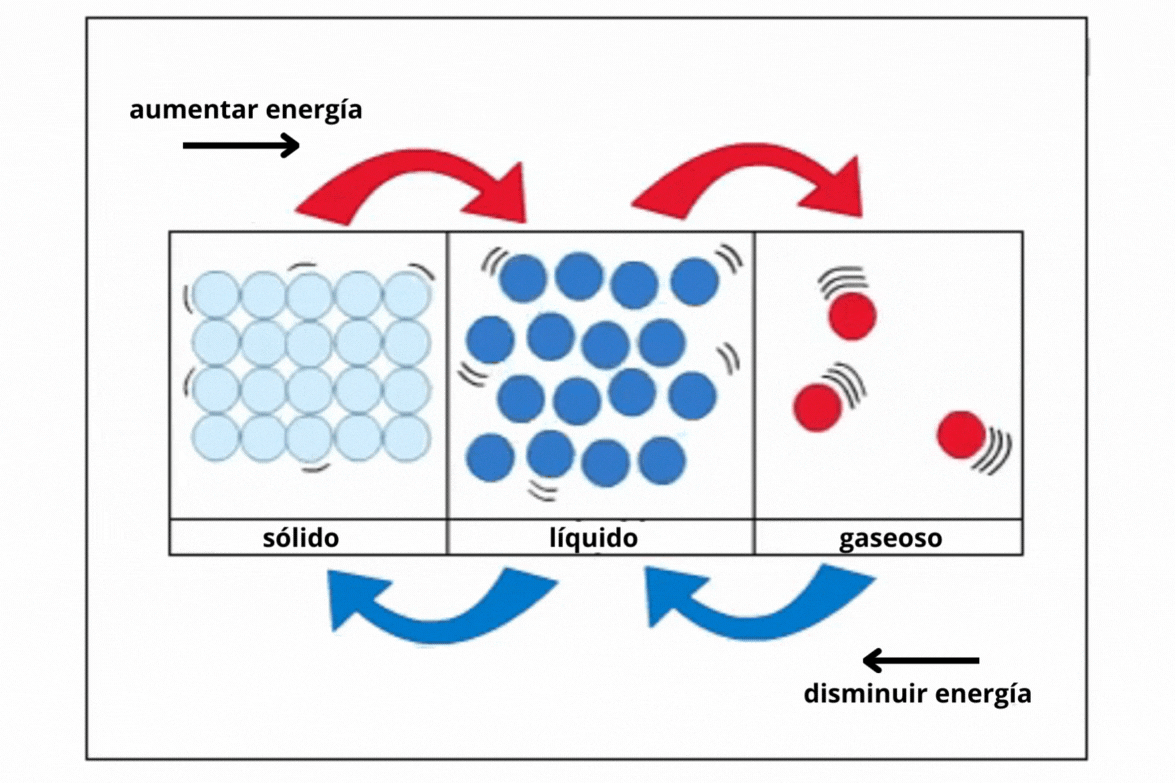
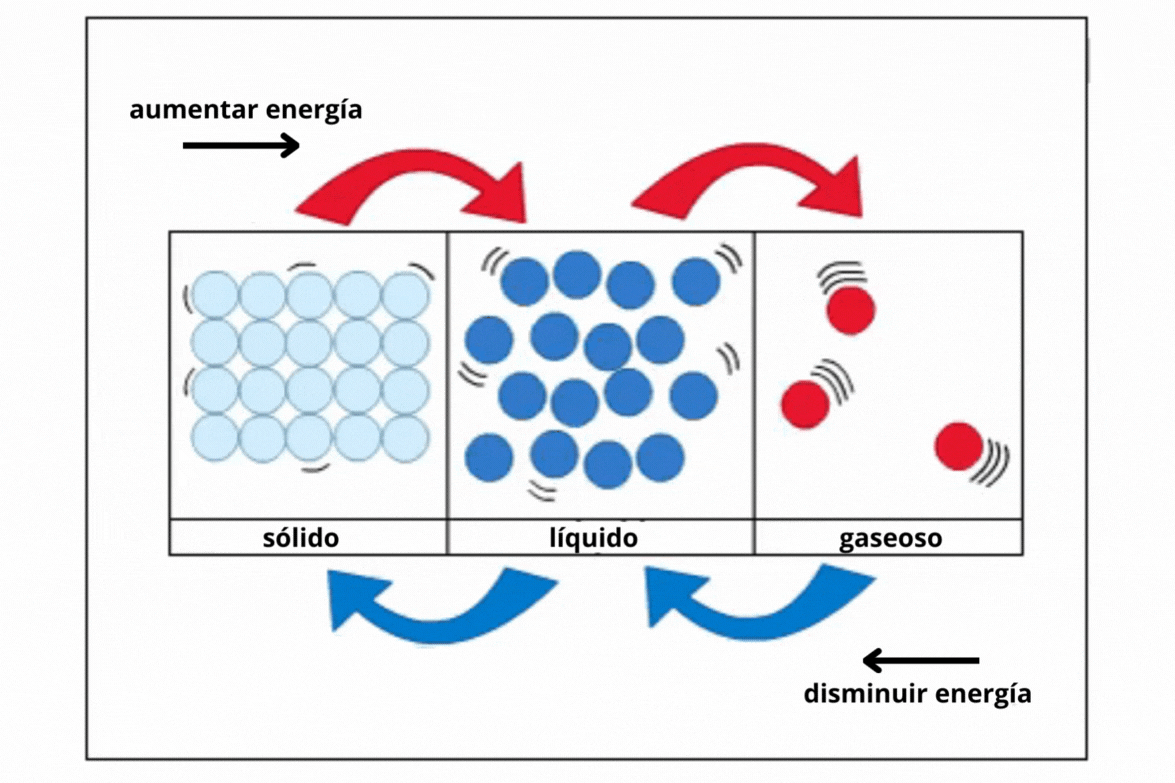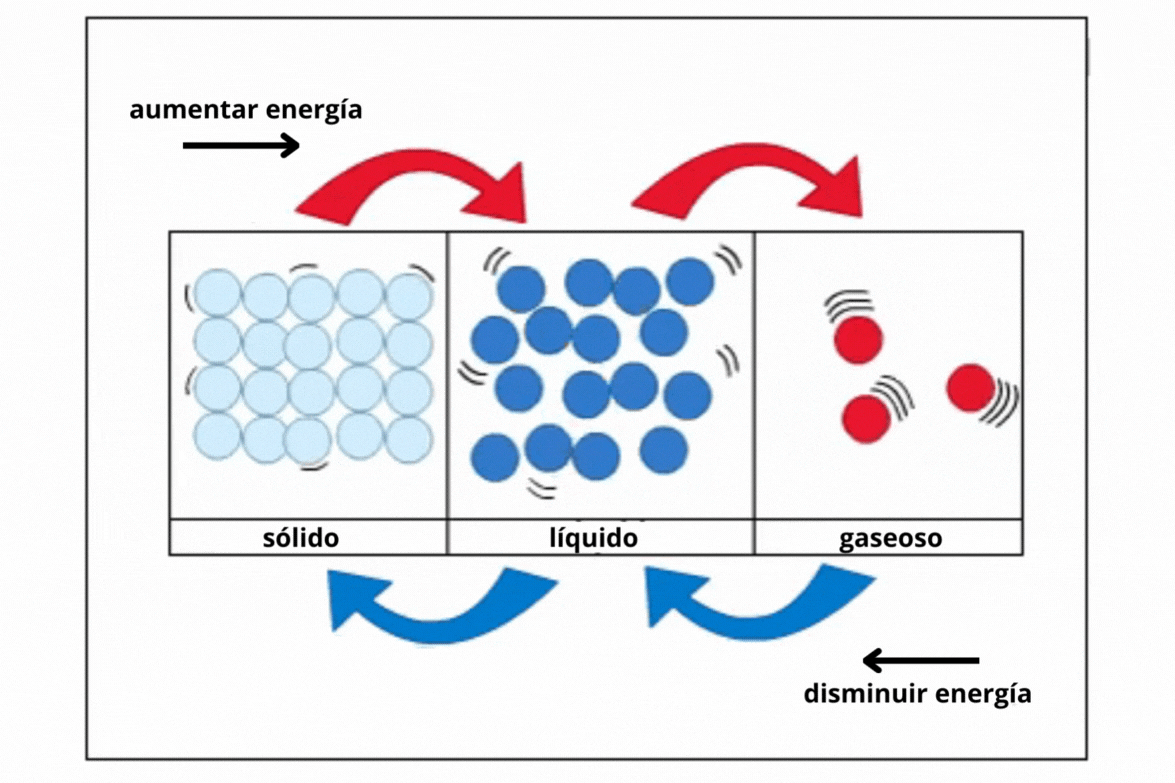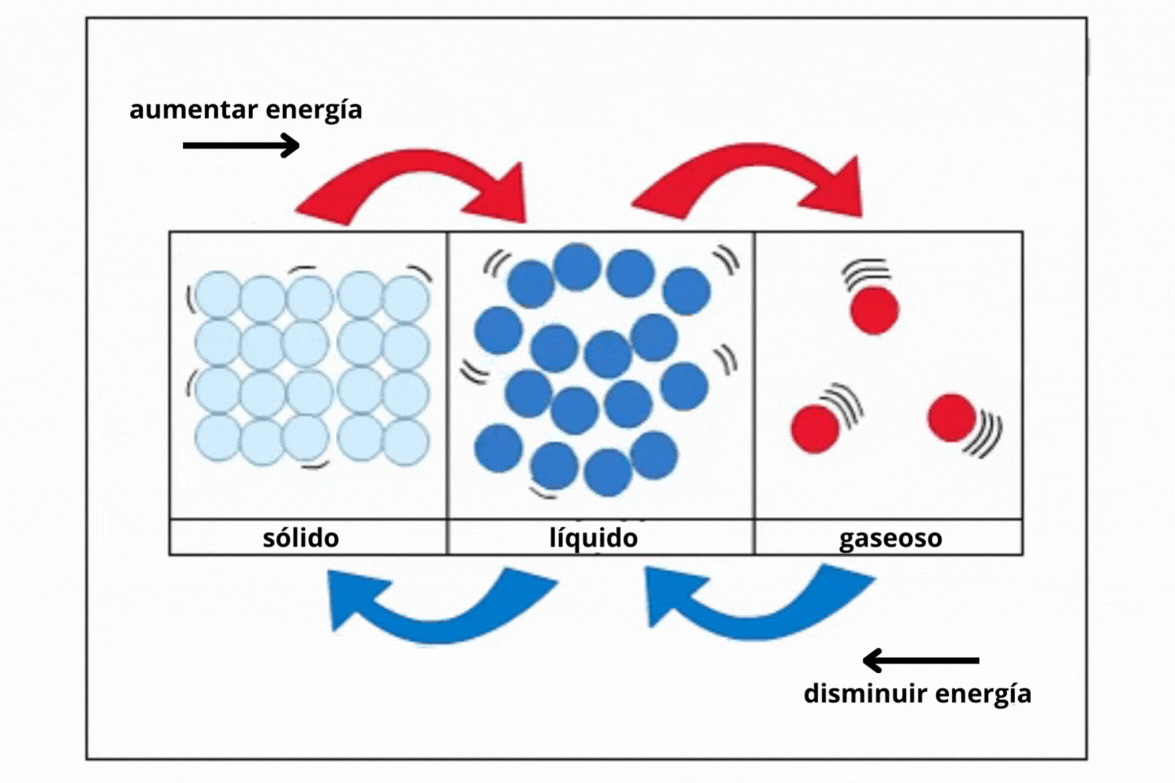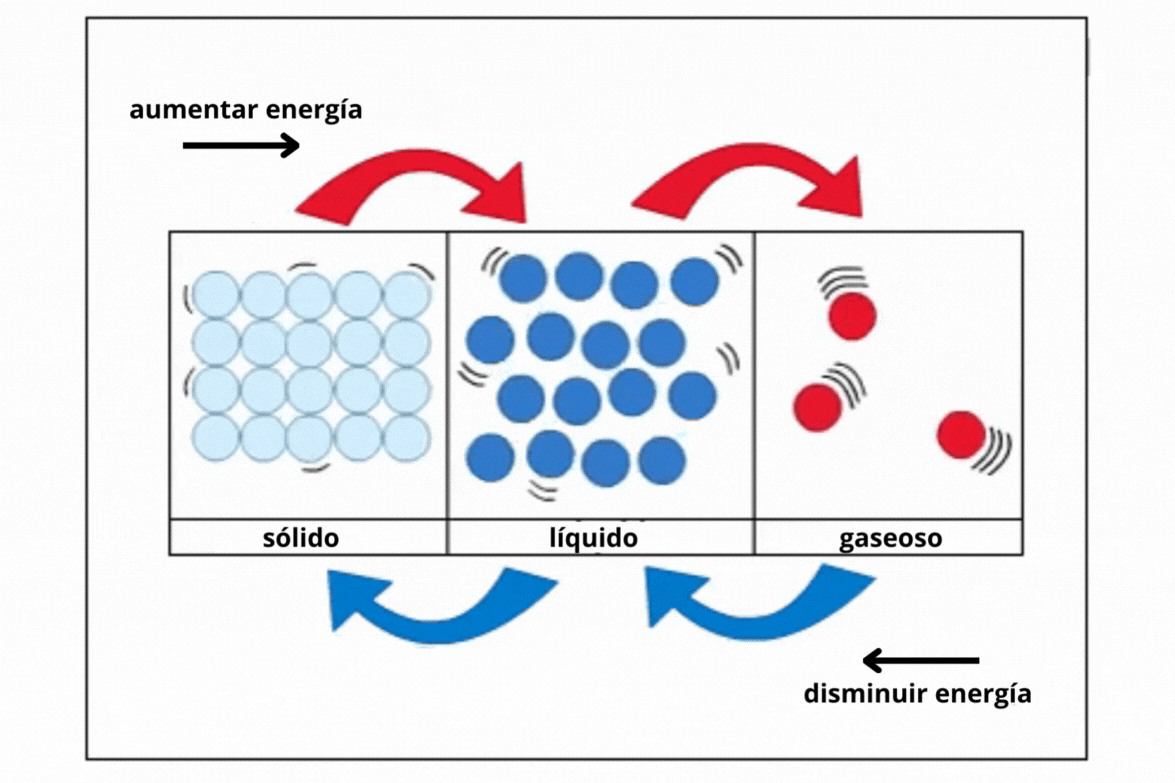
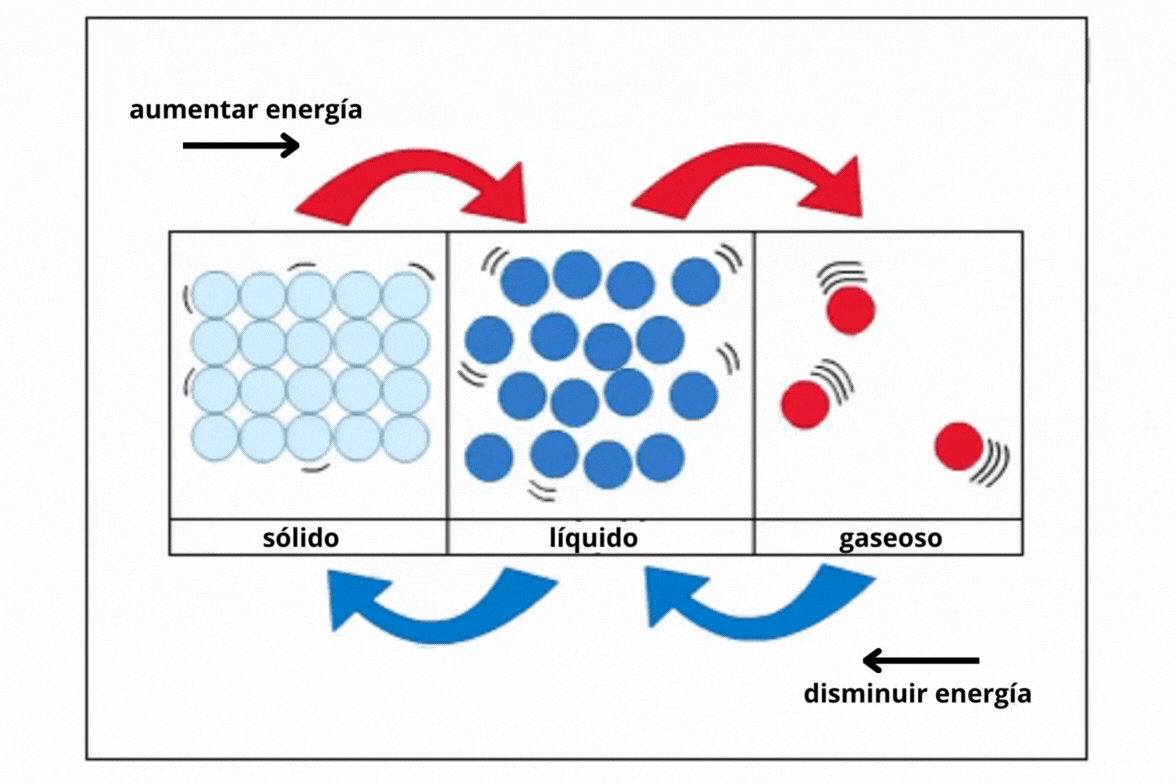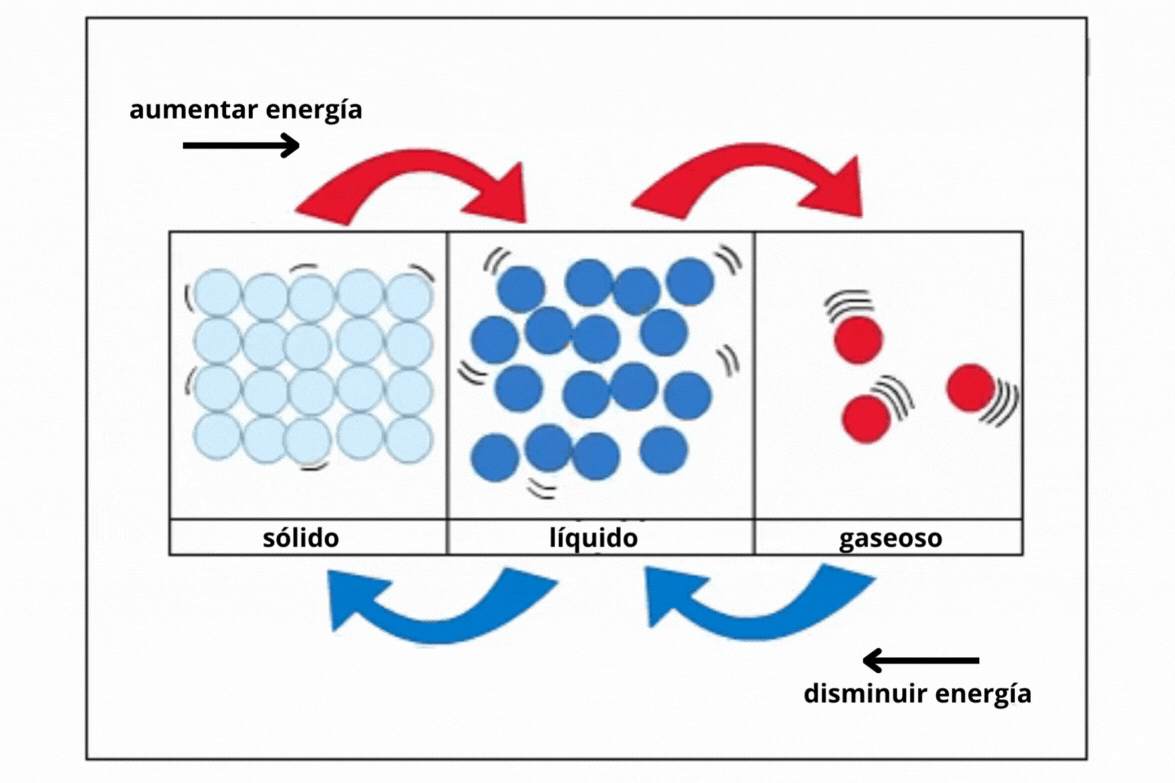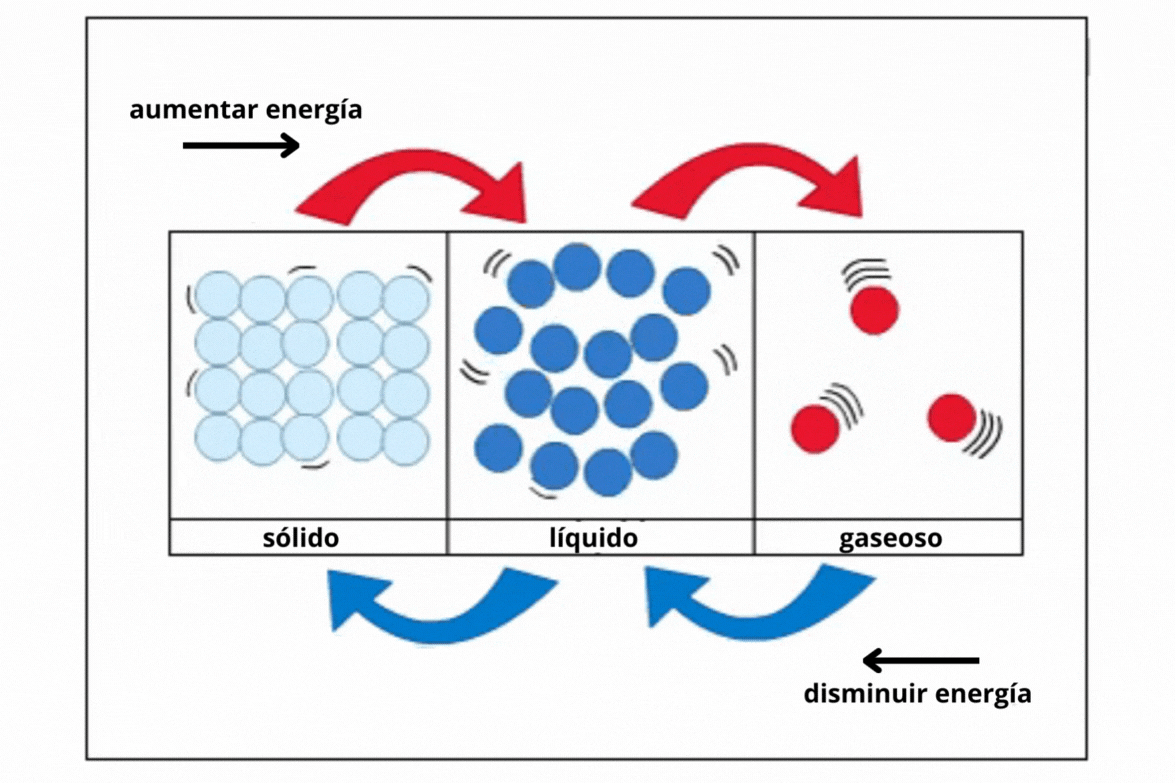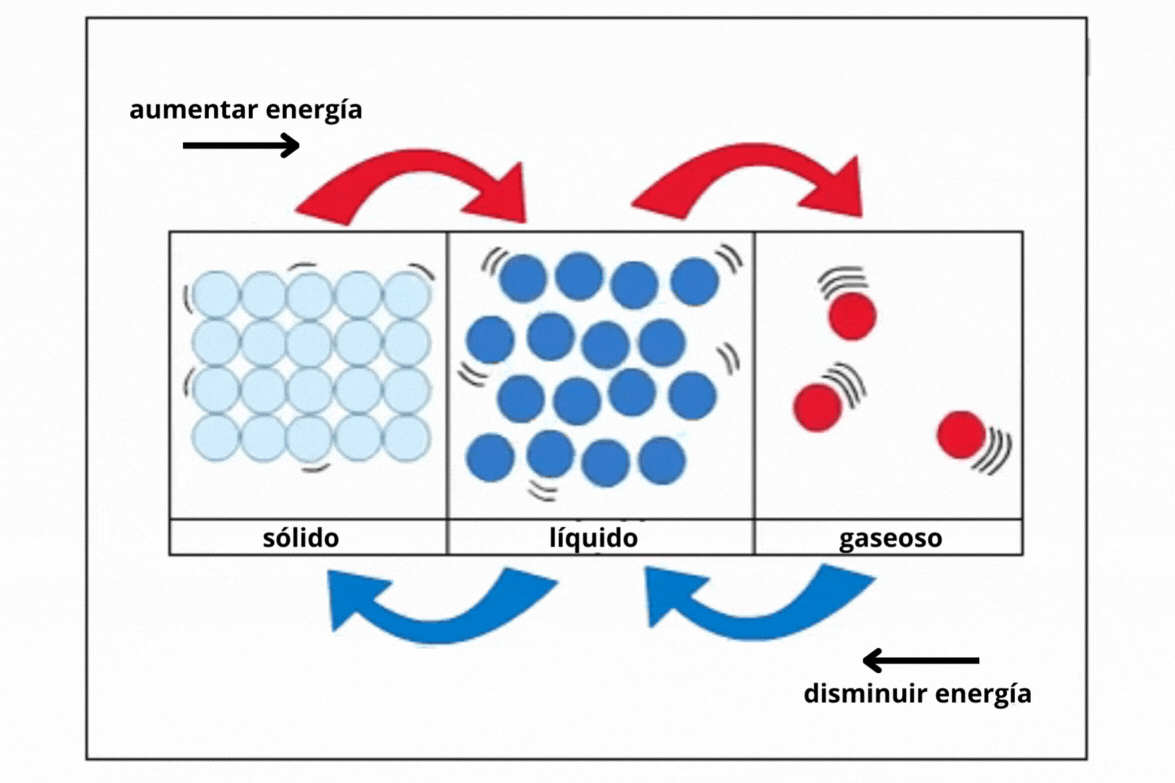
Estado de agregación |
Fórmula QuímicaLa
fórmula química es una forma de representar a una sustancia. La
fórmula química muestra la composición
química
de
la sustancia. La fórmula química utiliza símbolos químicos y subíndices numéricos. Los subíndices numéricos representan las cantidades relativas (proporciones) de los átomos de los diferentes elementos que forman la sustancia Por ejemplo, la fórmula química del agua es H₂O, y muestra que el agua está compuesta por los elementos hidrógeno y oxígeno, en proporción relativa 2 a 1.
|
Fuerzas De Van der WaalsLas
fuerzas de Van der Waals son un tipo de enlace de baja energía que
se establece entre las moléculas. Las fuerzas de Van der Waals son las fuerzas de atracción o fuerzas de repulsión entre las moléculas. Existen tres tipos de fuerzas de Van der Waals:
|
Gas |
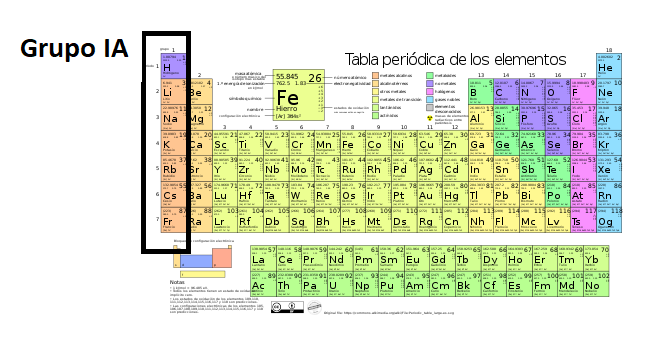
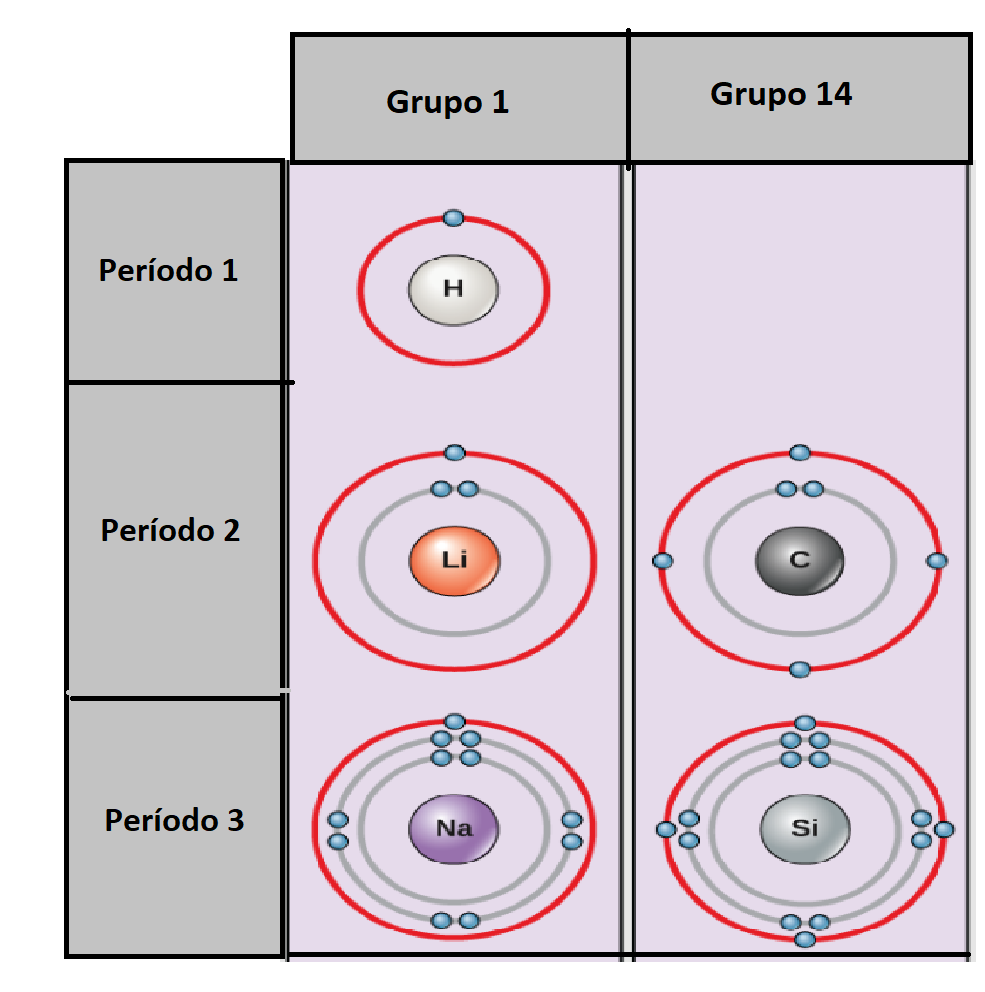
Grupo en la Tabla PeriódicaLos
grupos son las columnas de la tabla
periódica.
La tabla periódica tiene 18 grupos. Los elementos en cada grupo tienen propiedades químicas similares.
|
Interacción Dipolo - Dipolo (Fuerzas de Keesom)La interacción dipolo - dipolo se establece cuando una molécula polar (dipolo 1) se aproxima a otra molécula polar (dipolo 2). Esta interacción dipolo - dipolo mantiene unidas a las dos moléculas. La fuerza de la interacción dipolo - dipolo depende de:
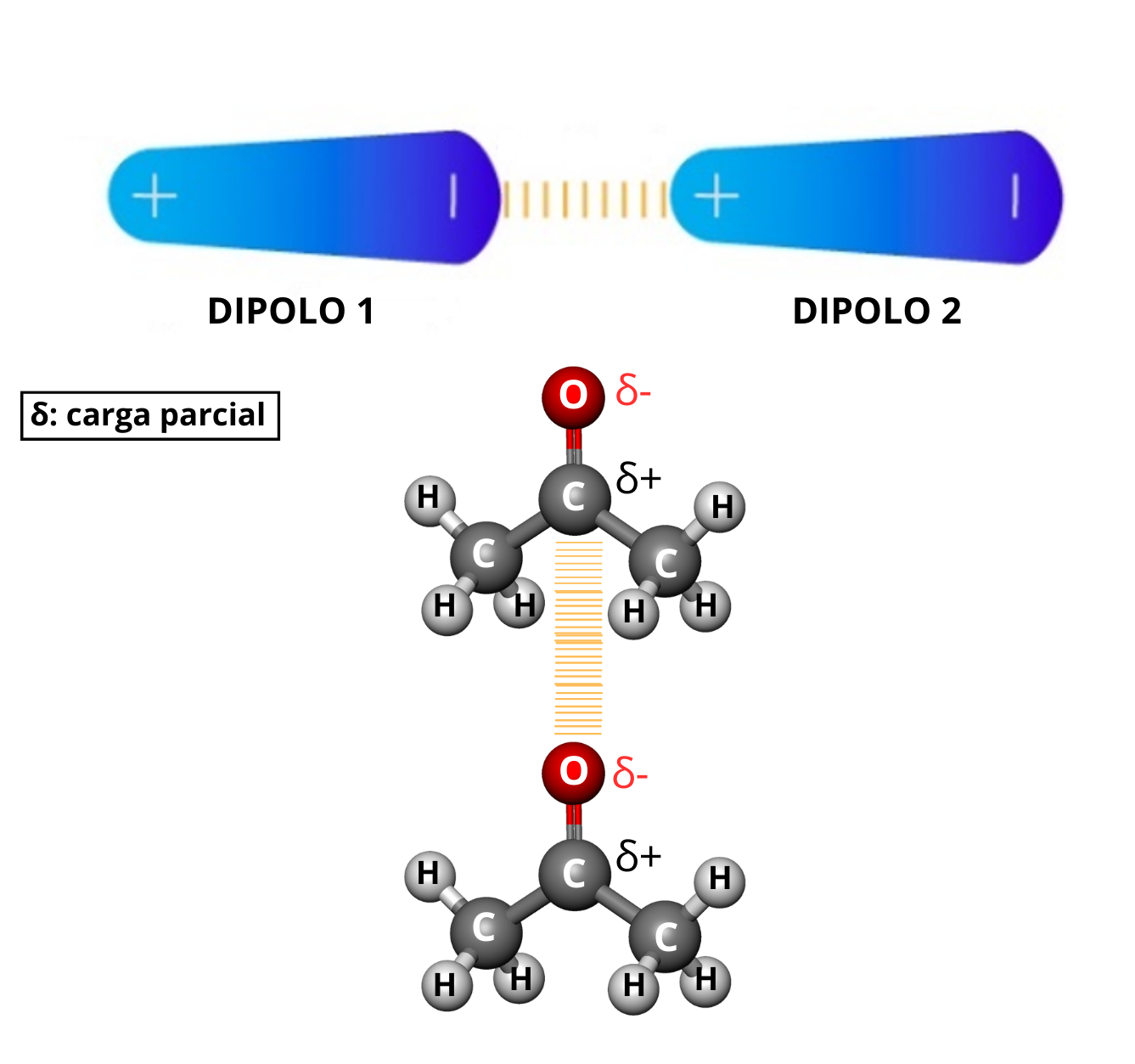 |
Ion |
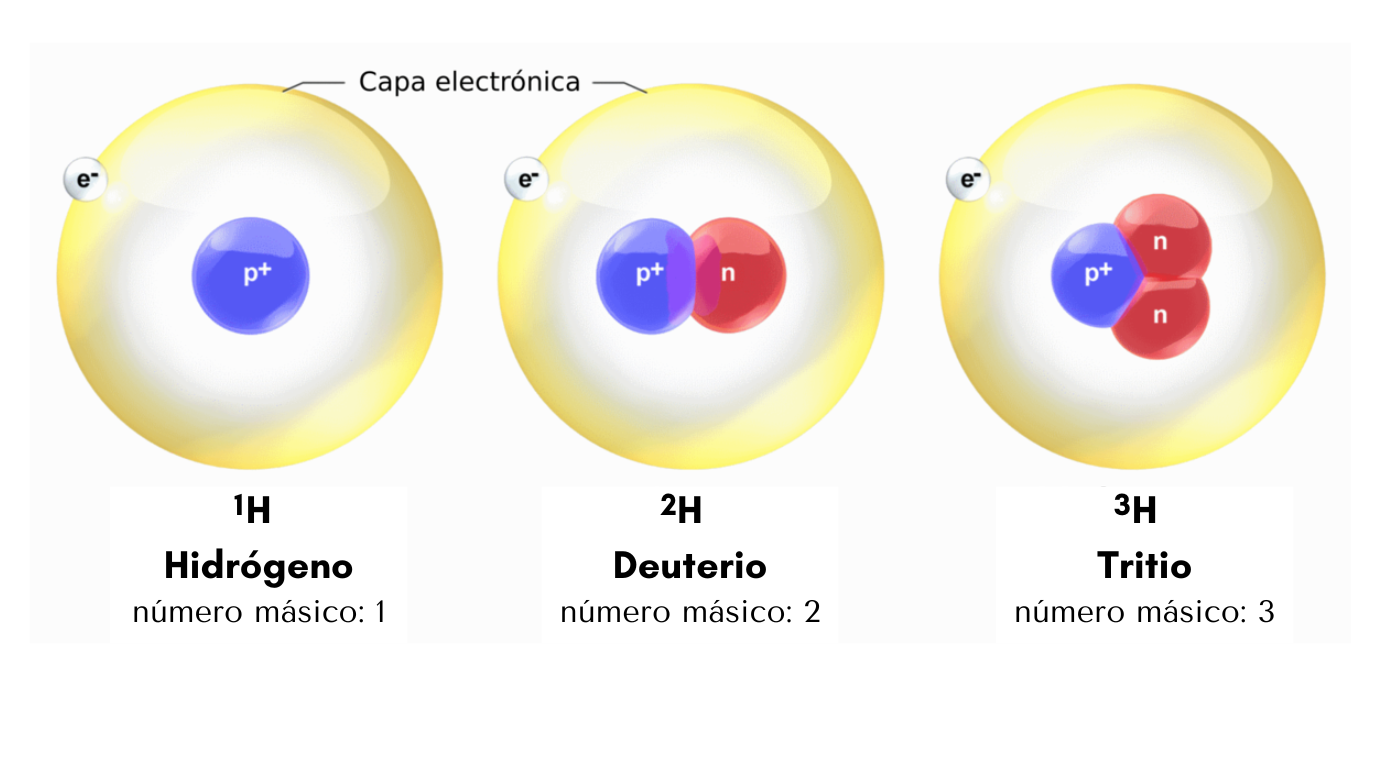
IsótoposLos
isótopos son átomos
de
un mismo elemento con diferente número
másico. Los isótopos tienen igual número de protones pero diferente número de neutrones. Por ejemplo, el elemento hidrógeno posee tres isótopos. El isótopo más abundante es el 1H que tiene un protón. Otro isótopo, el 2H, tiene 1 protón y 1 neutrón. El otro isótopo, el 3H, tiene 1 protón y 2 neutrones.
|
Líquido |
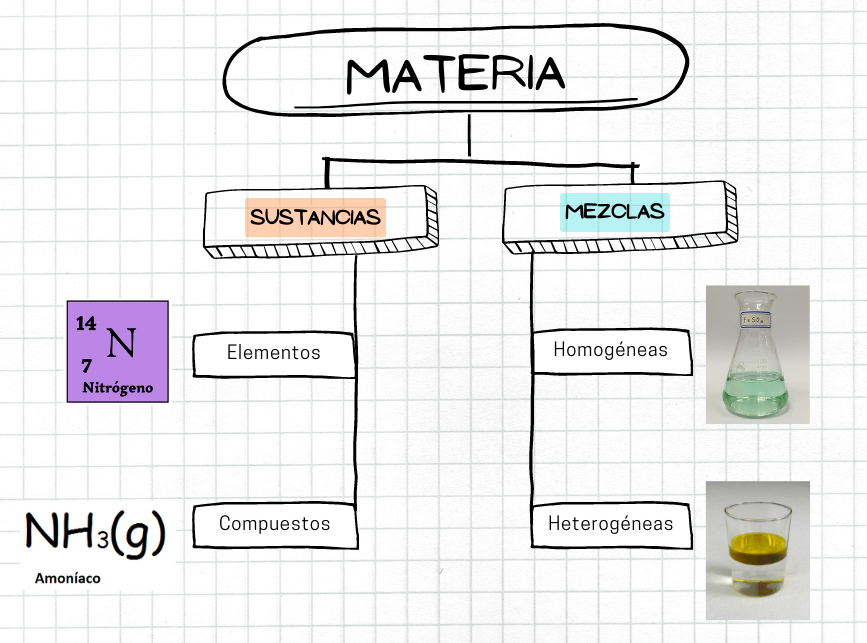
MateriaLa materia es el material físico del universo. La materia es lo que compone todo lo que está a nuestro alrededor. La materia tiene masa y volumen. Hay diferentes tipos de materia. Por ejemplo, algunos tipos de materia son las sustancias, como los elementos y los compuestos. Otro tipo de materia son las mezclas.
|
MoléculaLa
molécula es la unión de dos o más átomos. La unión de los átomos
en
las moléculas se da por enlaces
químicos. Los átomos que forman la molécula pueden ser del mismo elemento químico o de distintos elementos químicos. Las moléculas tienen propiedades físicas y químicas que las caracterizan. Un ejemplo de molécula es la molécula de agua. Su fórmula química es H2O. Está compuesta por un átomo de oxígeno y dos átomos de hidrógeno unidos por enlaces covalentes. |
Molécula ApolarUna molécula es apolar si su momento dipolar neto es igual a cero. Las moléculas que no presentan regiones con cargas parciales son apolares (Ejemplo: molécula de oxígeno). Las moléculas que tienen enlaces polares son apolares cuando el momento dipolar neto es cero (Ejemplo: molécula de dióxido de carbono). |
NeutrónUn
neutrón es una partícula sin carga. El neutrón se encuentra en el
núcleo
del
átomo. La cantidad de neutrones en el núcleo define el isótopo del elemento. Por ejemplo, el elemento nitrógeno posee dos isótopos. Un isótopo,
14N, tiene átomos
con
7 protones
y
7 neutrones. El otro isótopo,
15N, tiene átomos
con
7 protones
y
8 neutrones. 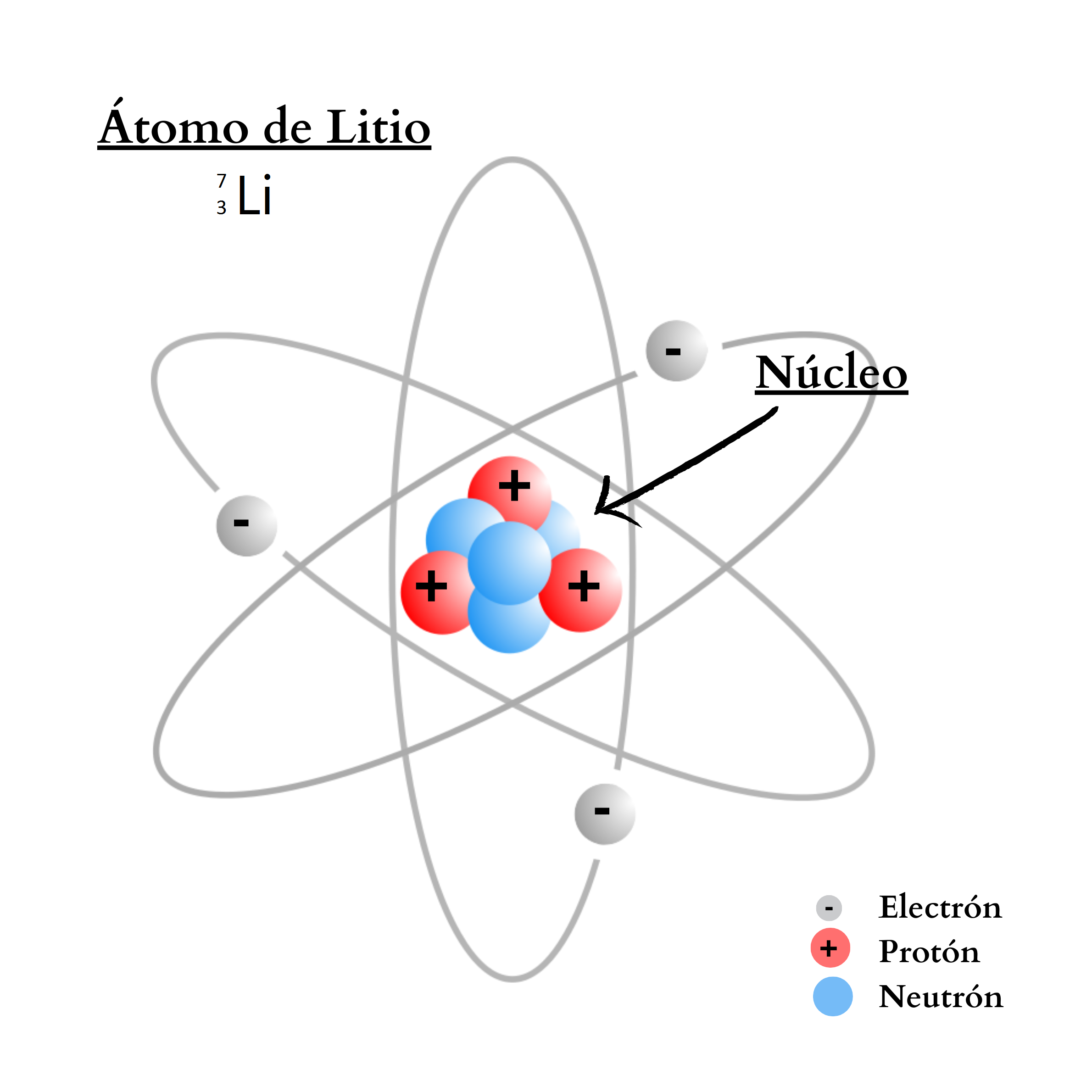 |
Núcleo del Átomo |
Número AtómicoEl
número atómico indica la cantidad de protones
que
tiene un átomo
de
un elemento
en
el núcleo. El número atómico define al elemento. Por ejemplo, todos los átomos del elemento nitrógeno tienen número atómico igual a 7, por lo que poseen 7 protones en su núcleo. En cambio, todos los átomos del elemento calcio tienen número atómico igual a 20, por lo que poseen 20 protones en su núcleo.
|
Número MásicoEl
número másico de un átomo
indica
la cantidad de protones
y
neutrones
que
tiene el núcleo
atómico. El número másico se simboliza con la letra A y se coloca a la izquierda y arriba del símbolo químico del elemento. Por ejemplo, los átomos más abundantes del elemento nitrógeno se simbolizan como 14N, poseen 7 protones y 7 neutrones. Los átomos de un mismo elemento con diferente número másico se llaman isótopos. Los isótopos tienen igual número de protones pero diferente número de neutrones. Por ejemplo, el elemento nitrógeno posee dos isótopos. Un isótopo, 14N, tiene átomos con 7 protones y 7 neutrones. El otro isótopo, 15N tiene átomos con 7 protones y 8 neutrones.
|
PartículaLa partícula es un fragmento pequeño de materia. Algunas partículas, son tan pequeñas que no podemos verlas a simple vista. Ejemplos: átomos y moléculas.
|
Periferia AtómicaLa periferia atómica es la zona del átomo que rodea al núcleo atómico. En la periferia atómica se encuentran los electrones. La periferia atómica tiene una región interna, más cercana al núcleo. La periferia atómica tiene una región externa más alejada del núcleo. En la región interna están los electrones internos del átomo. En la región externa de la periferia están los electrones de valencia del átomo. Los electrones de valencia son los electrones que participan en el enlace químico.
|
Período en la Tabla PeriódicaLos
períodos son las filas de la tabla periódica. La tabla
periódica
tiene
7 períodos. |
ProtónUn protón es una partícula de carga positiva. El protón se encuentra
en el núcleo
del
átomo. La cantidad de protones en el núcleo define al elemento. Por ejemplo, todos los átomos del elemento nitrógeno poseen 7 protones en su núcleo. En cambio, todos los átomos del elemento calcio poseen 20 protones en su núcleo. |
Repulsión ElectrostáticaLa repulsión electrostática es la interacción entre cargas eléctricas del mismo signo. La repulsión electrostática hace que las cargas del mismo signo se repelan. En el caso de moléculas polares la repulsión electrostática se establece entre cargas parciales del mismo signo.
|
Símbolo QuímicoEl
símbolo químico es una forma de representar a un elemento
químico
con
letras. Cada elemento químico se representa con un símbolo químico formado por una letra mayúscula o por dos letras, una mayúscula y una minúscula. Por ejemplo, el elemento nitrógeno se representa como N, y el elemento calcio como Ca. El símbolo químico, además de las letras, puede incluir el número másico y el número atómico. Cada elemento químico se compone de un solo tipo de átomo.
|
Sólido |
Sustancia
La sustancia es un tipo de materia que tiene composición fija y propiedades definidas. Si se modifica la composición química de una sustancia se transforma en una nueva sustancia. Un sistema que contiene dos o más sustancias es una mezcla.
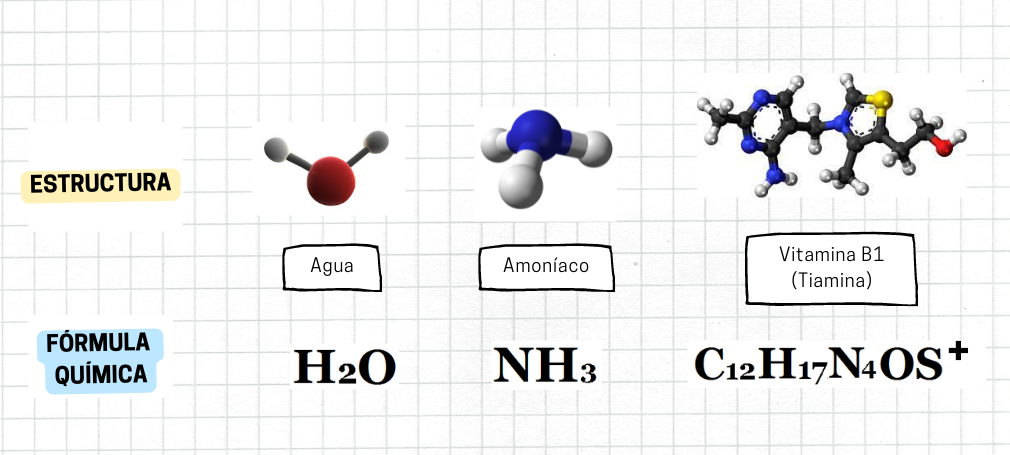
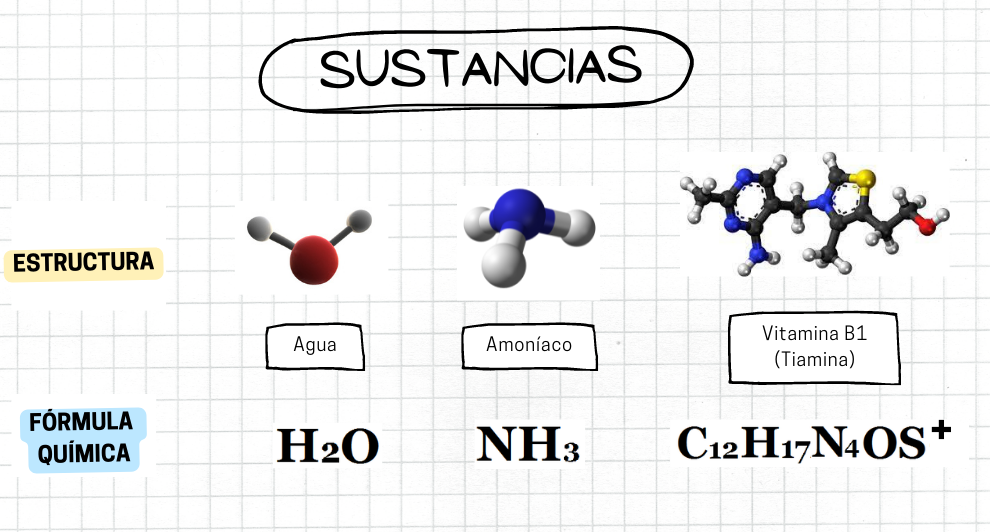
Sustancias Distintos ejemplos de sustancias, indicando sus estructuras químicas y fórmulas químicas. Los ejemplos son: agua, amoníaco y tiamina. Agua El primer ejemplo es el agua: hache mayúscula, abajo a la derecha como subíndice dos, o mayúscula. La estructura molecular del agua se representa con una esfera de color rojo para el átomo de oxígeno, unida a dos esferas de color blanco más pequeñas para los átomos de hidrógeno. Entre ambos enlaces hay un ángulo de 104°. Amoníaco El segundo ejemplo corresponde al amoníaco: ene mayúscula, hache mayúscula, subíndice tres. La estructura molecular del amoníaco se representa con una esfera de color azul para el átomo de nitrógeno, unida a tres esferas de color blanco y menor tamaño para el hidrógeno. El ángulo entre cada par de enlaces es de 108°. Vitamina B1 El tercer ejemplo corresponde a la tiamina, Vitamina B1: ce mayúscula, subíndice doce, hache mayúscula, subíndice diecisiete, ene mayúscula, subíndice cuatro, o mayúscula, ese mayúscula, arriba a la derecha como superíndice, más. Su estructura molecular se representa por esferas de diferentes colores, representando a los átomos y conectadas entre sí, en una estructura más compleja que las anteriores |
PROPIEDADES Y MEDICIÓN |
|---|
Actividad (concentración efectiva)La actividad de un soluto es la concentración real de ese soluto que participa en un proceso químico. La actividad o concentración efectiva del soluto considera las interacciones entre los componentes del sistema. La actividad se define como: En soluciones diluidas el coeficiente de actividad se acerca a 1 y la actividad es similar a la concentración En soluciones diluidas el coeficiente |
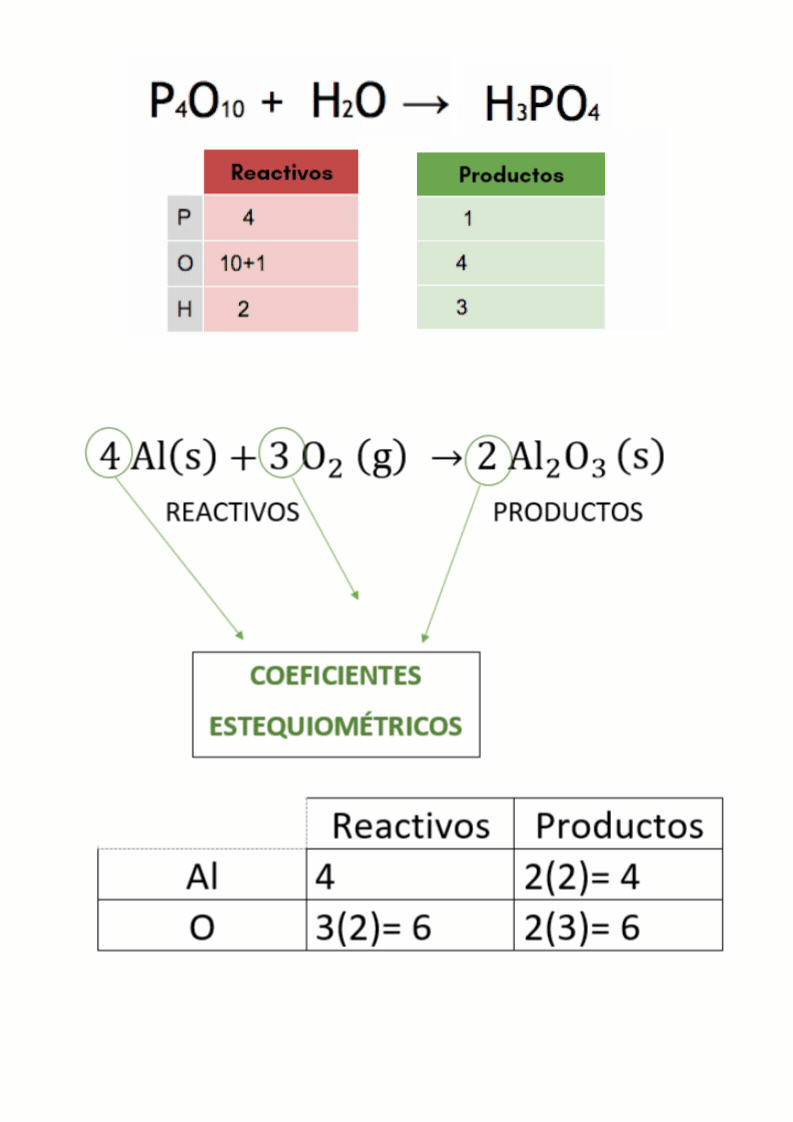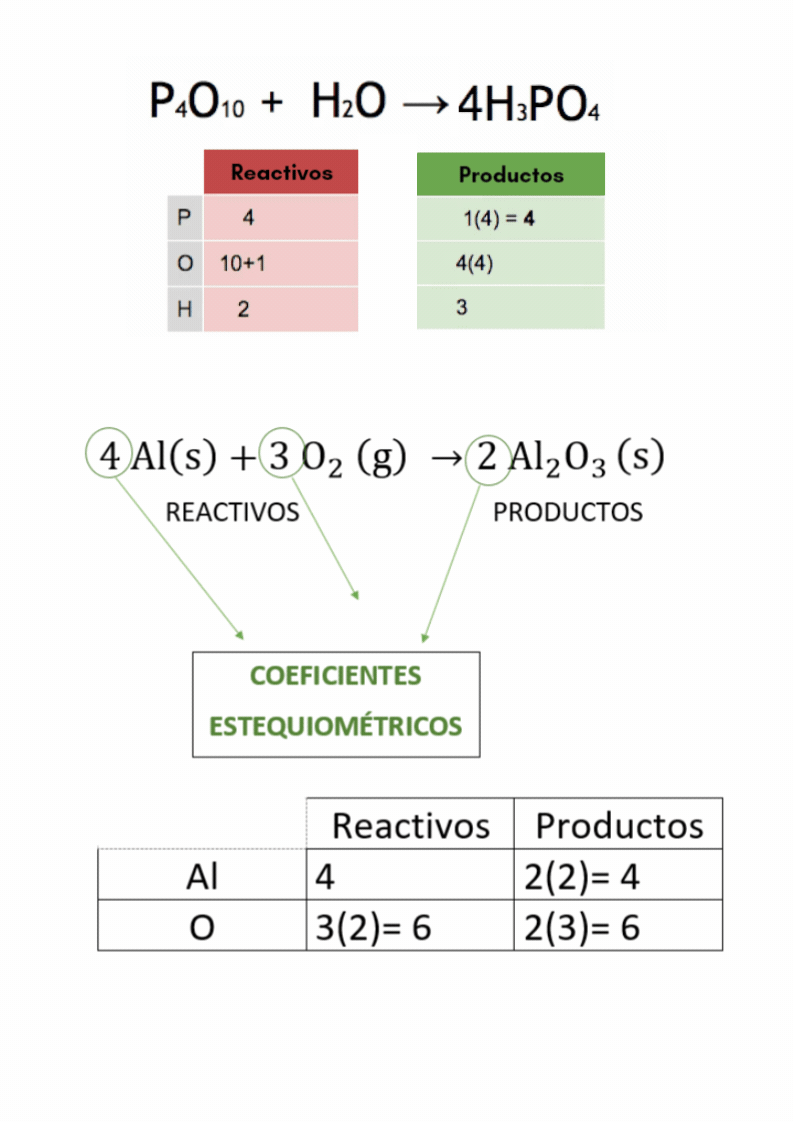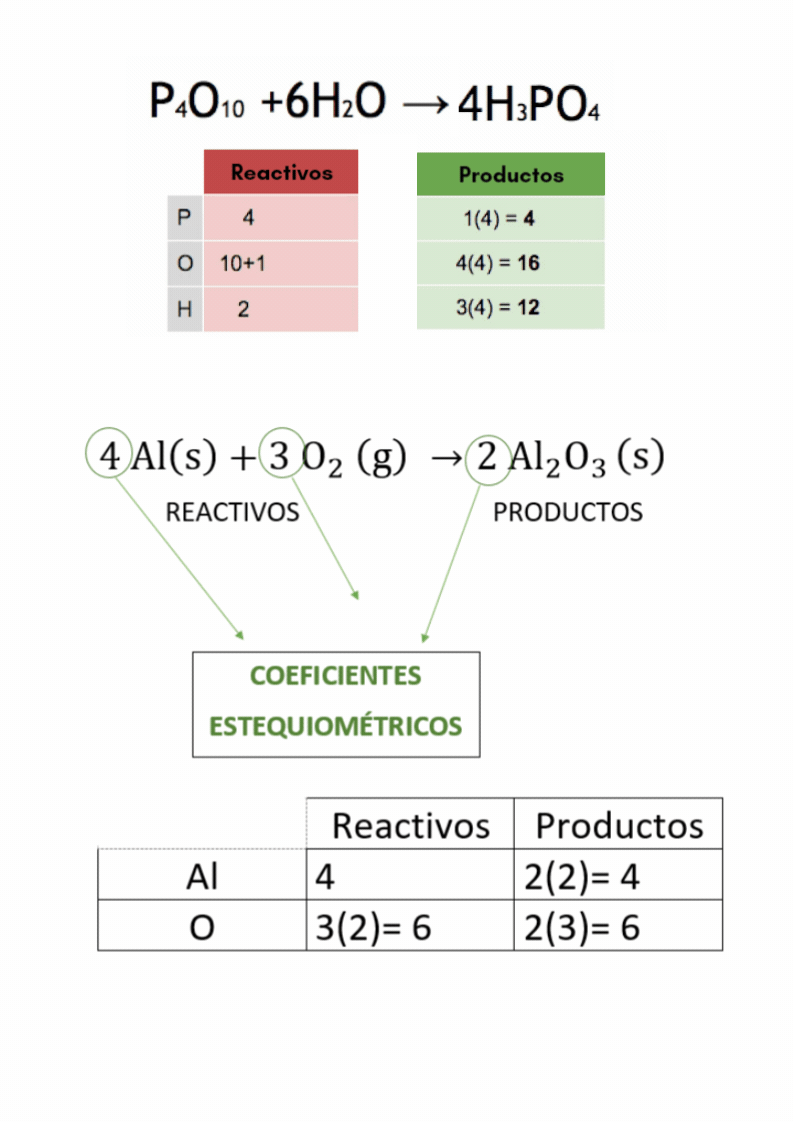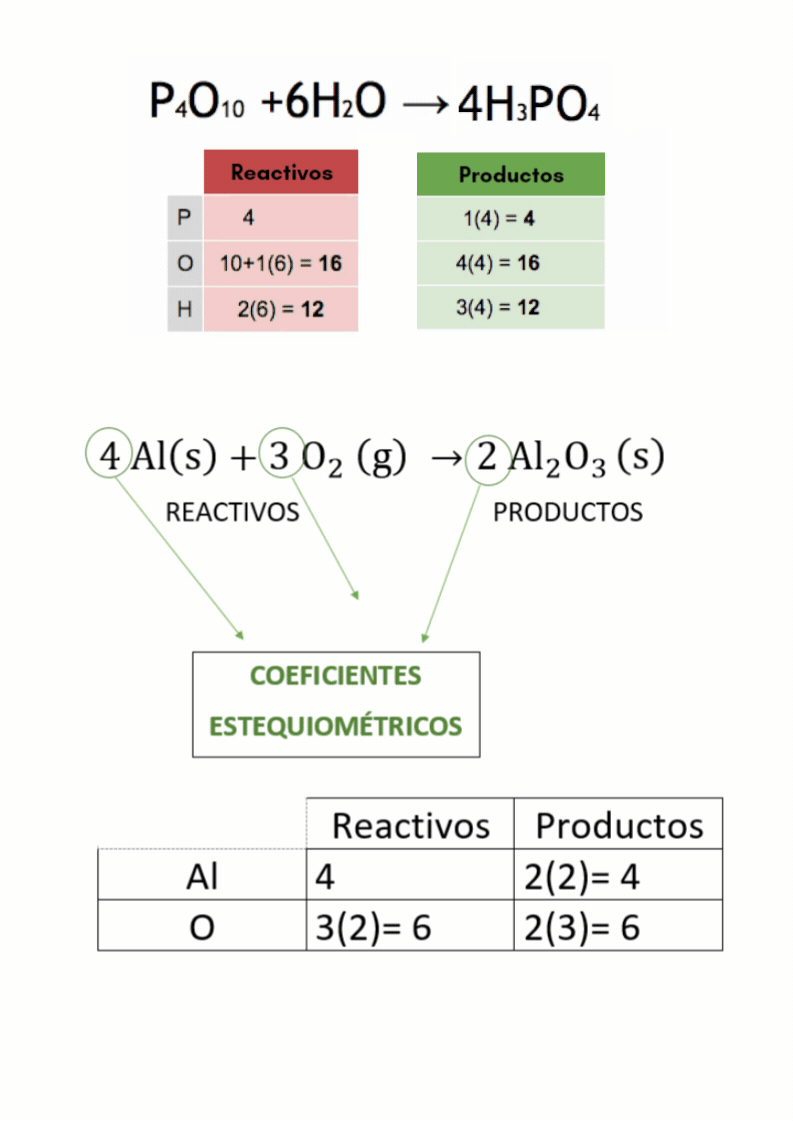
Balanceo o igualación de ecuaciones químicas |