GLOSARIO DE QUÍMICA
GLOSARIO DE QUÍMICA
Especial | A | B | C | D | E | F | G | H | I | J | K | L | M | N | Ñ | O | P | Q | R | S | T | U | V | W | X | Y | Z | TODAS
M |
|---|
Magnitud |
Masa |
MateriaLa materia es el material físico del universo. La materia es lo que compone todo lo que está a nuestro alrededor. La materia tiene masa y volumen. Hay diferentes tipos de materia. Por ejemplo, algunos tipos de materia son las sustancias, como los elementos y los compuestos. Otro tipo de materia son las mezclas. 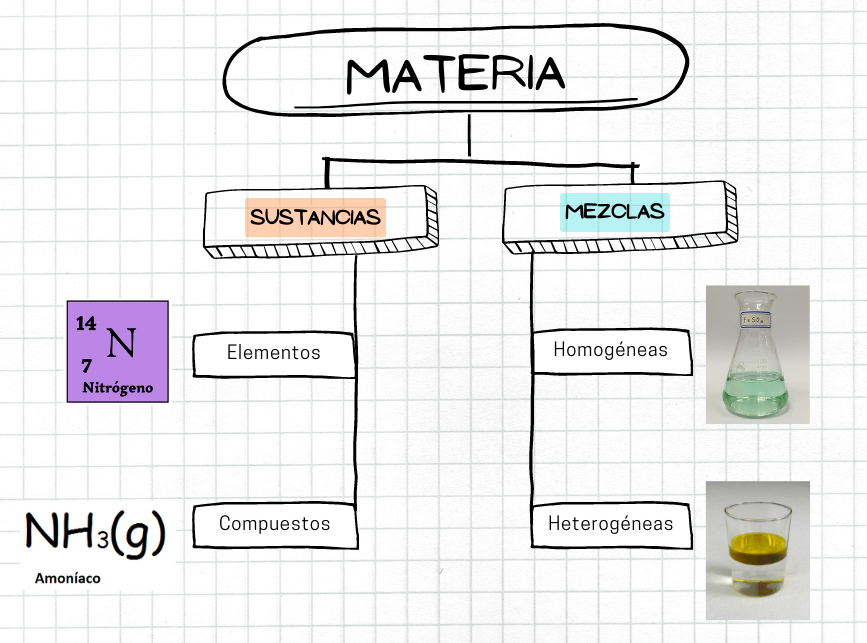 |
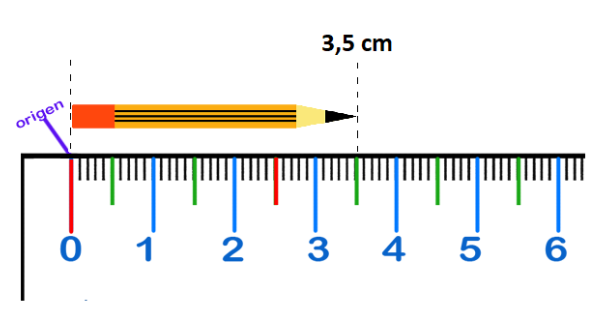
MediciónLa
medición es el proceso de comparar una cantidad desconocida que
queremos determinar con una cantidad conocida de la misma magnitud,
que se usa como referencia o unidad. Al resultado del proceso de medición se le llama medida. |
Medida |
MezclaUna mezcla es un tipo de materia que está formada por dos o más sustancias. En una mezcla, cada sustancia conserva su composición química. Las sustancias tienen composición química fija. En cambio, la composición de una mezcla puede variar. Existen dos tipos de mezclas: las mezclas homogéneas y las mezclas heterogéneas.
|
Mezcla Heterogénea |
Mezcla Homogénea |
MoléculaLa
molécula es la unión de dos o más átomos. La unión de los átomos
en
las moléculas se da por enlaces
químicos. Los átomos que forman la molécula pueden ser del mismo elemento químico o de distintos elementos químicos. Las moléculas tienen propiedades físicas y químicas que las caracterizan. Un ejemplo de molécula es la molécula de agua. Su fórmula química es H2O. Está compuesta por un átomo de oxígeno y dos átomos de hidrógeno unidos por enlaces covalentes.
 |
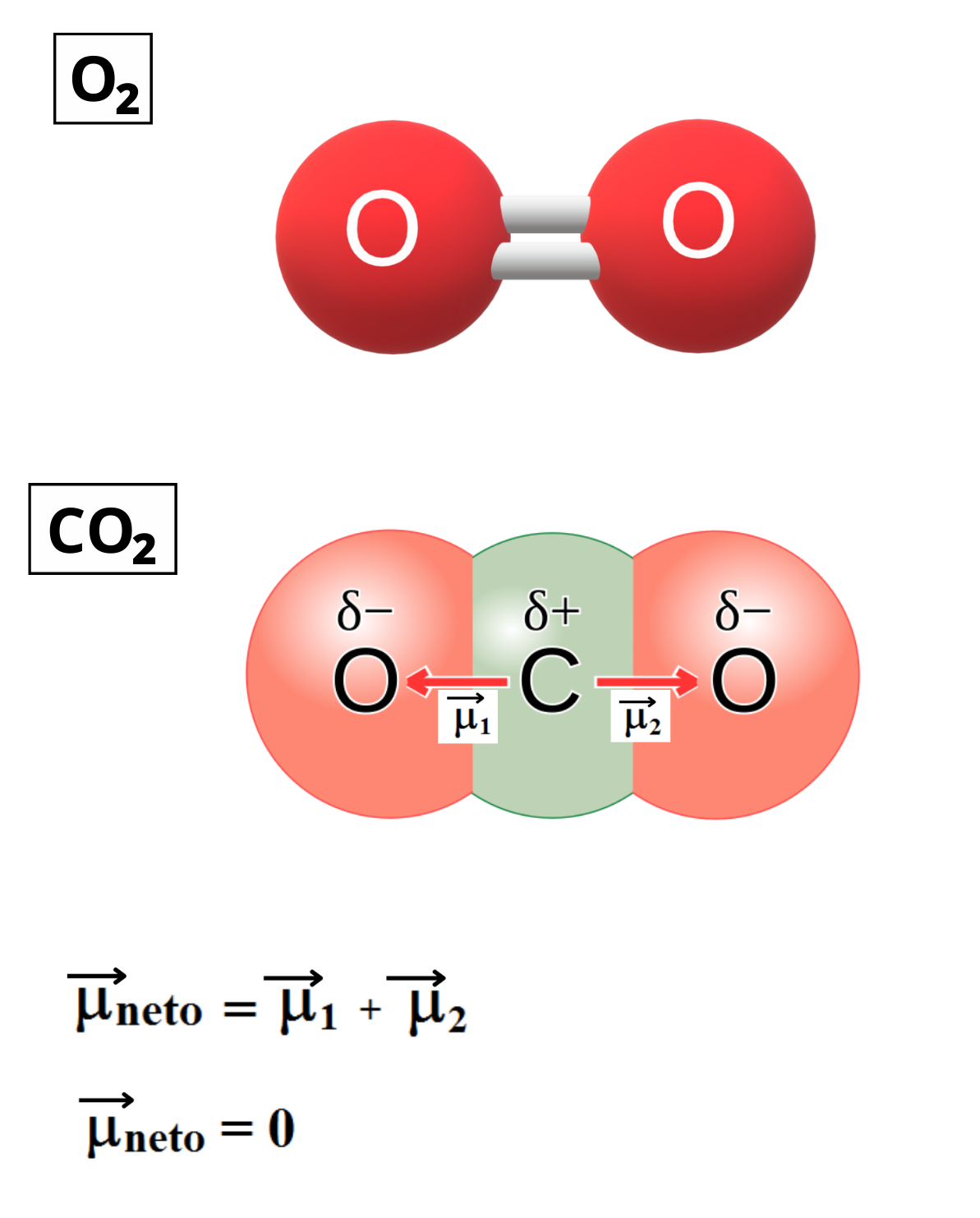
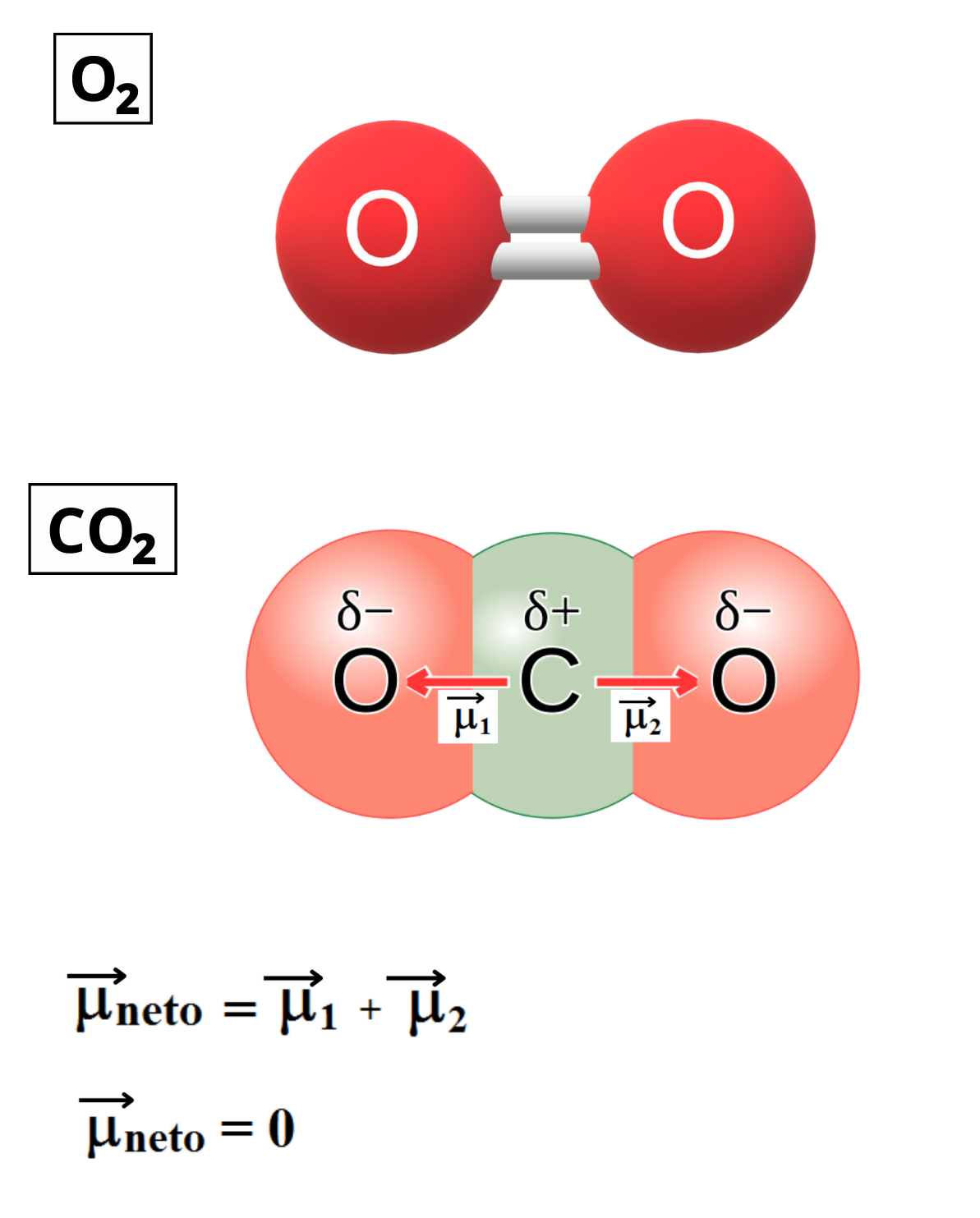
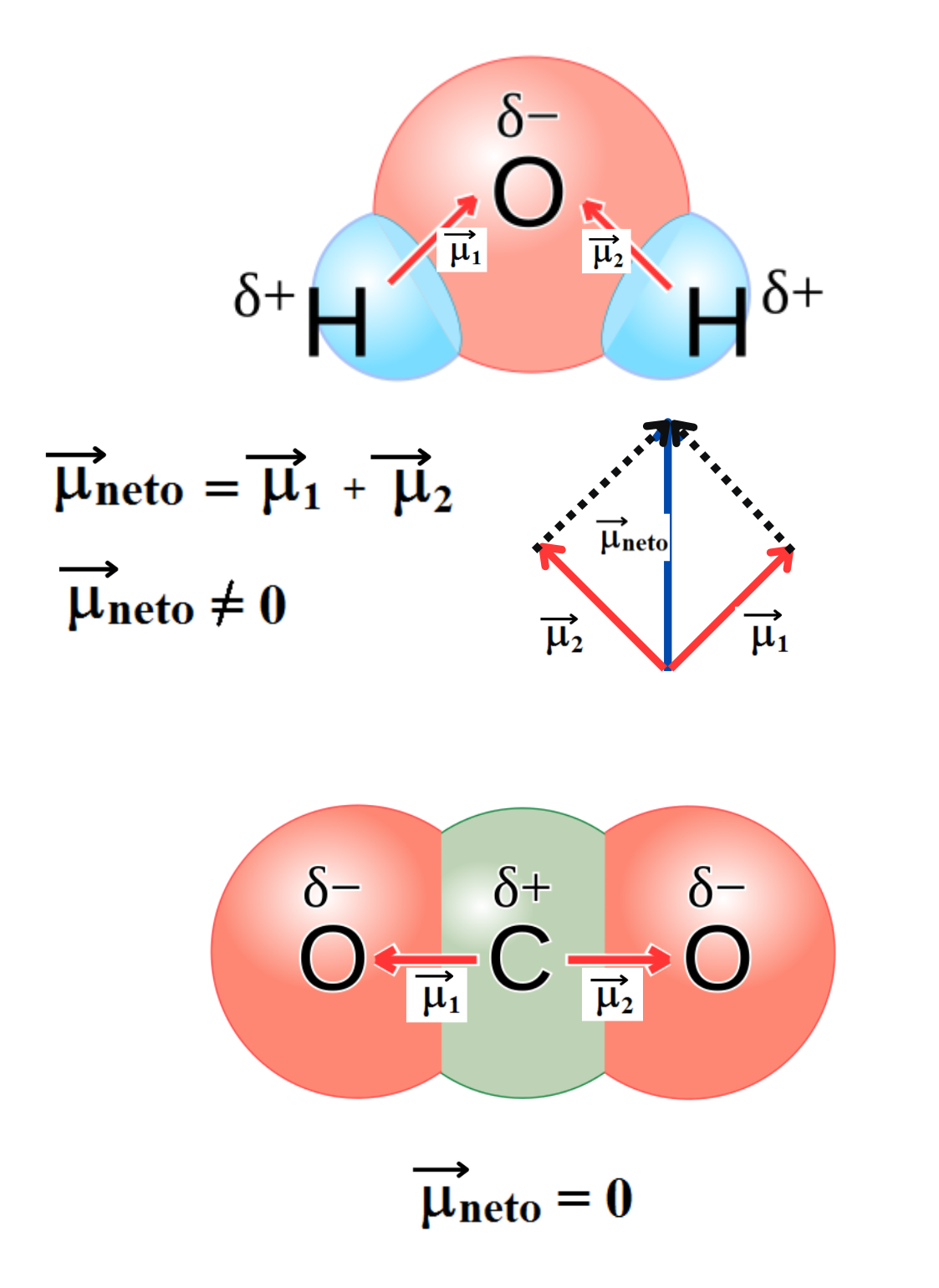
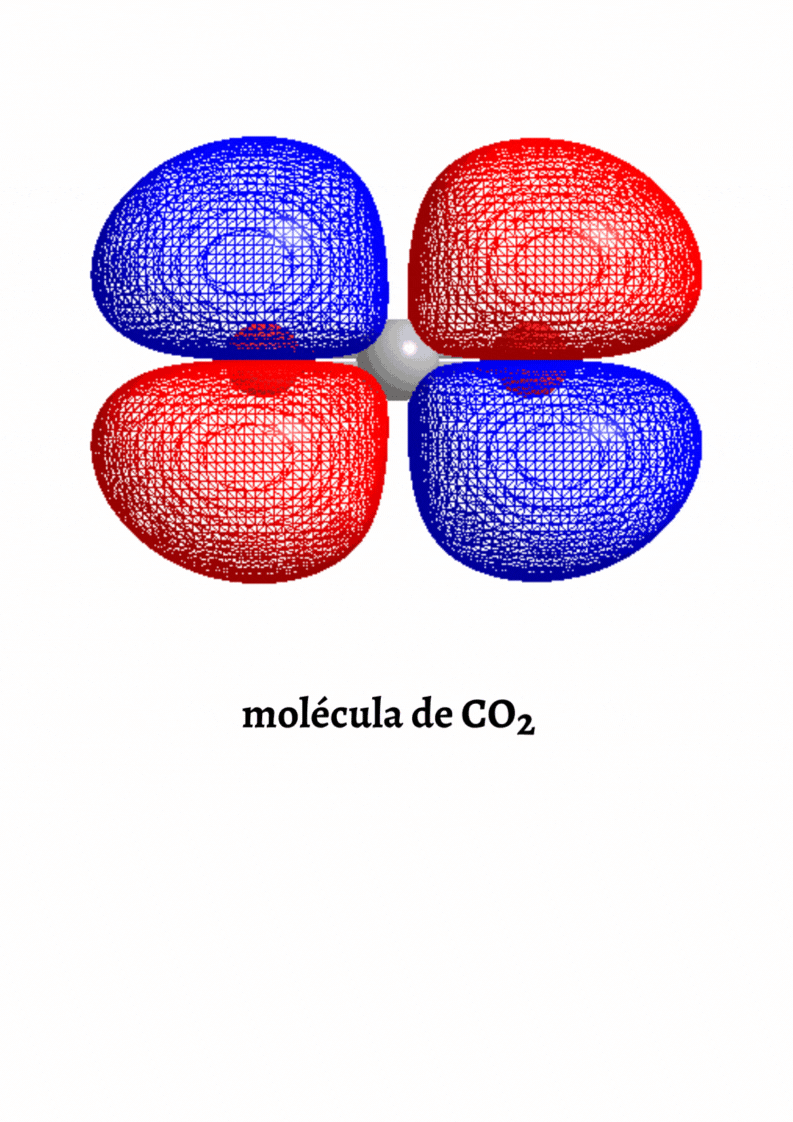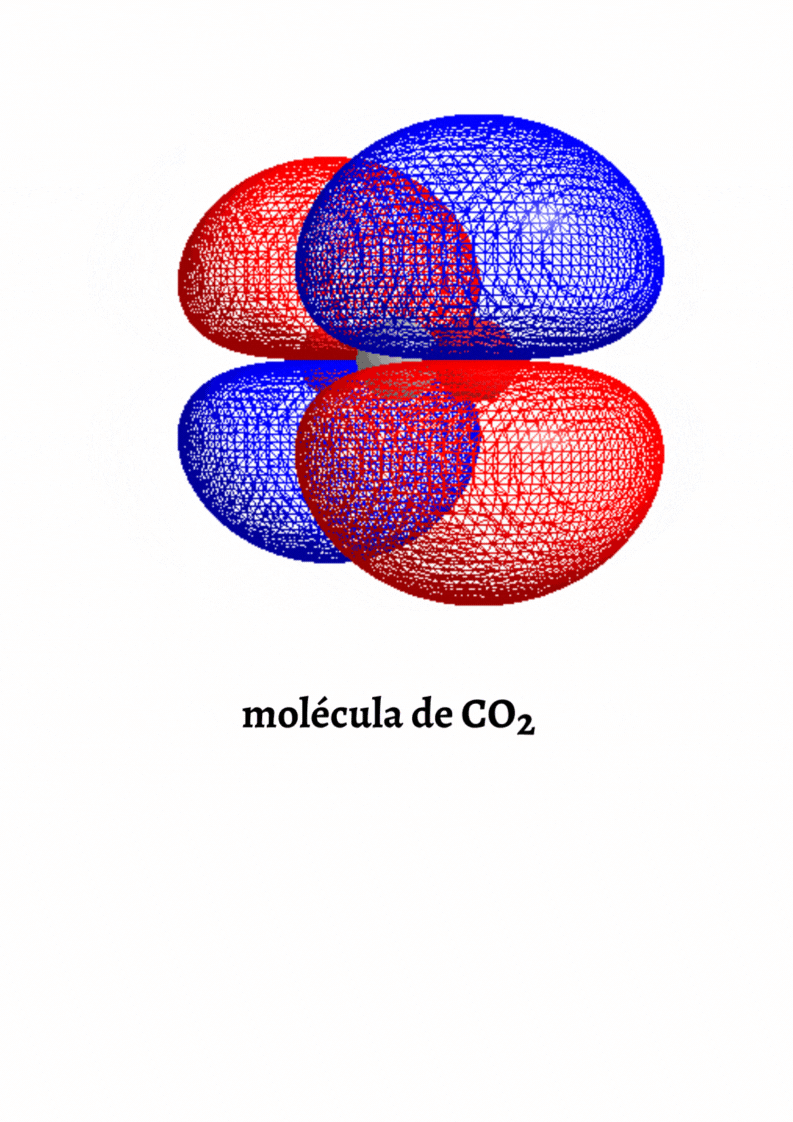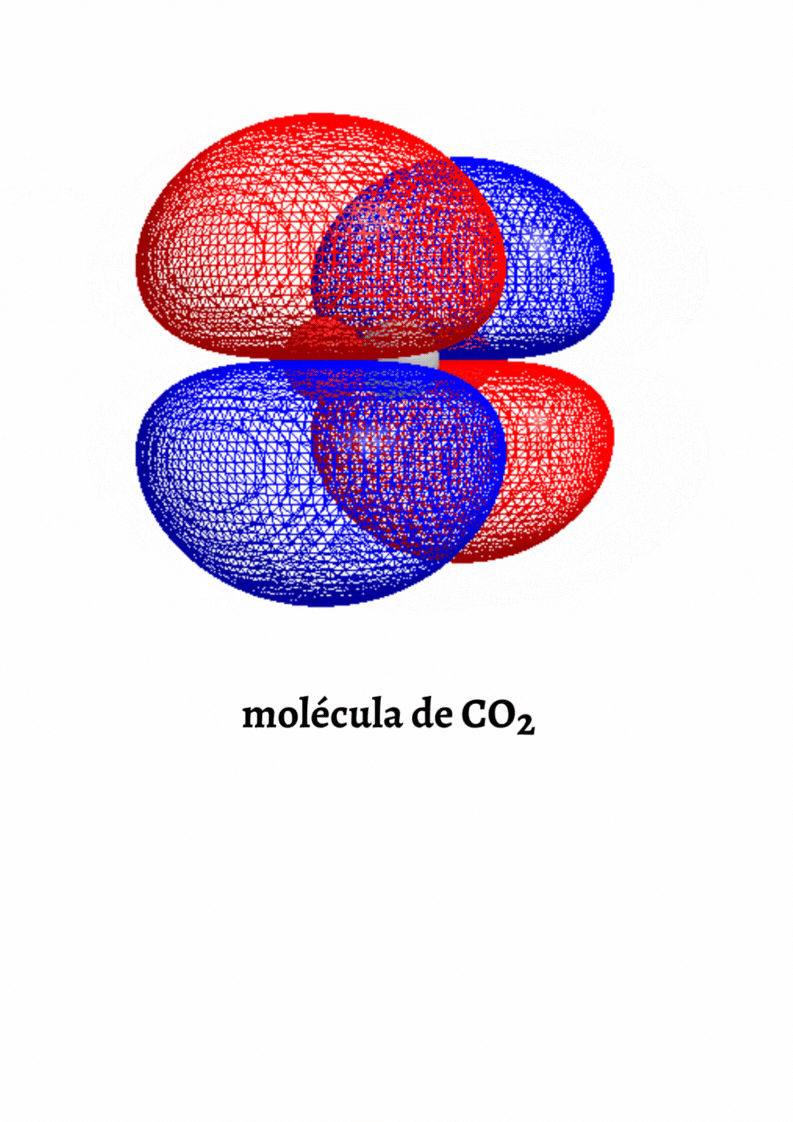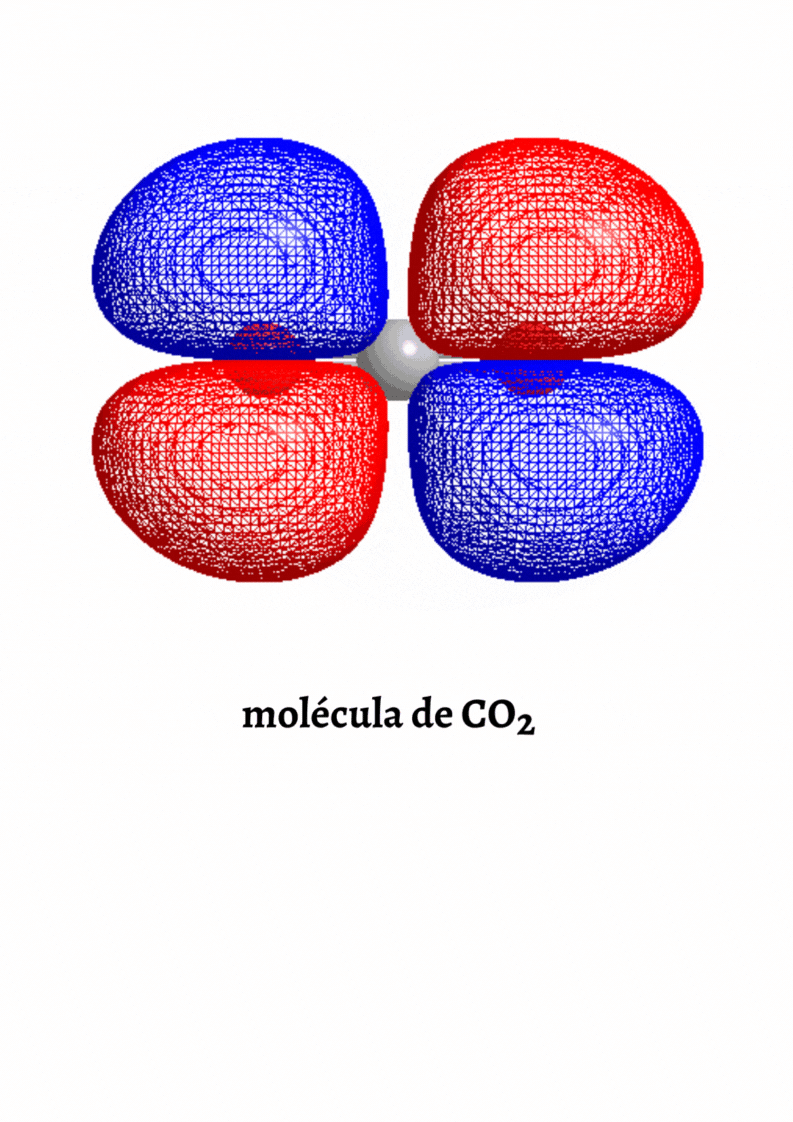
MOLÉCULA APOLAR
Molécula Apolar. Una molécula es apolar si su momento dipolar neto es igual a cero. Las moléculas que no presentan regiones con cargas parciales son apolares (Ejemplo: molécula de oxígeno). Las moléculas que tienen enlaces polares son apolares cuando el momento dipolar neto es cero (Ejemplo: molécula de dióxido de carbono).
|
MOLÉCULA POLAR |
MOMENTO DIPOLAR
Momento Dipolar. El momento dipolar se define como el producto entre las cargas y la distancia entre dichas cargas. El momento dipolar es una magnitud vectorial. NOTA: En química es común representar el momento dipolar con un vector (flecha) que apunta desde la carga parcial positiva hacia la carga parcial negativa. En la convención moderna y en física, el vector apunta hacia la carga parcial positiva.
|
N |
|---|
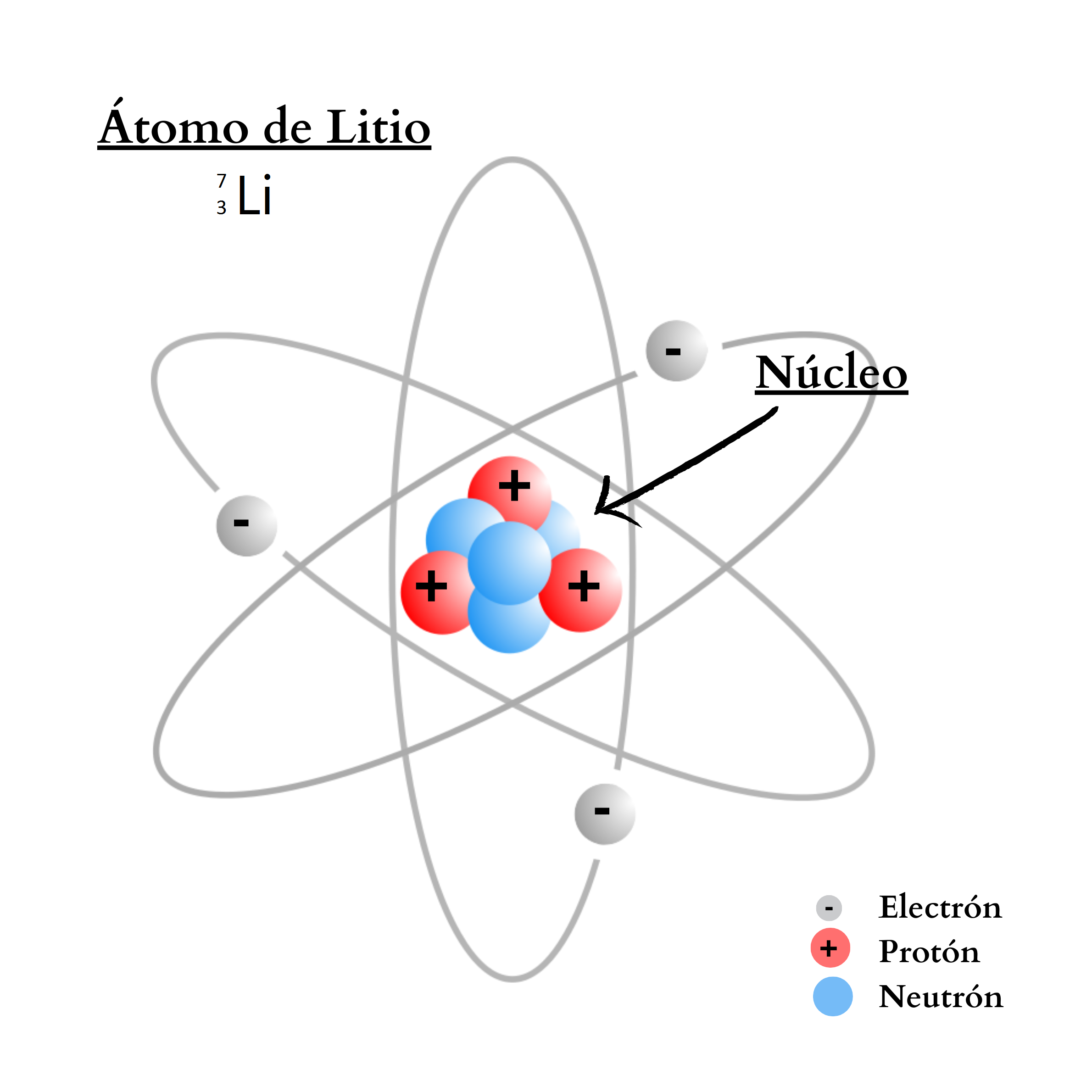
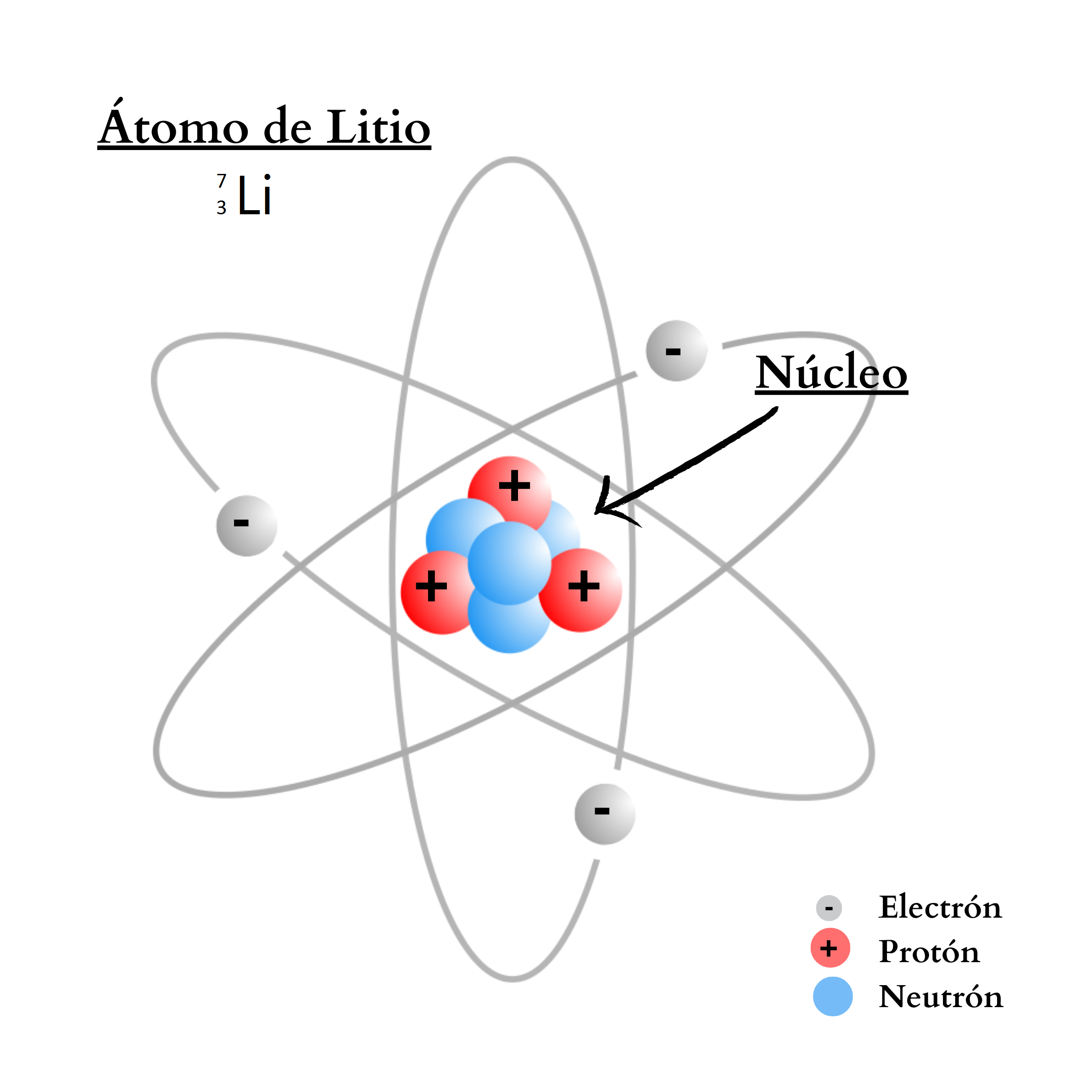
NeutrónUn
neutrón es una partícula sin carga. El neutrón se encuentra en el
núcleo
del
átomo. La cantidad de neutrones en el núcleo define el isótopo del elemento. Por ejemplo, el elemento nitrógeno posee dos isótopos. Un isótopo,
14N, tiene átomos
con
7 protones
y
7 neutrones. El otro isótopo,
15N, tiene átomos
con
7 protones
y
8 neutrones.
|
Núcleo del Átomo |
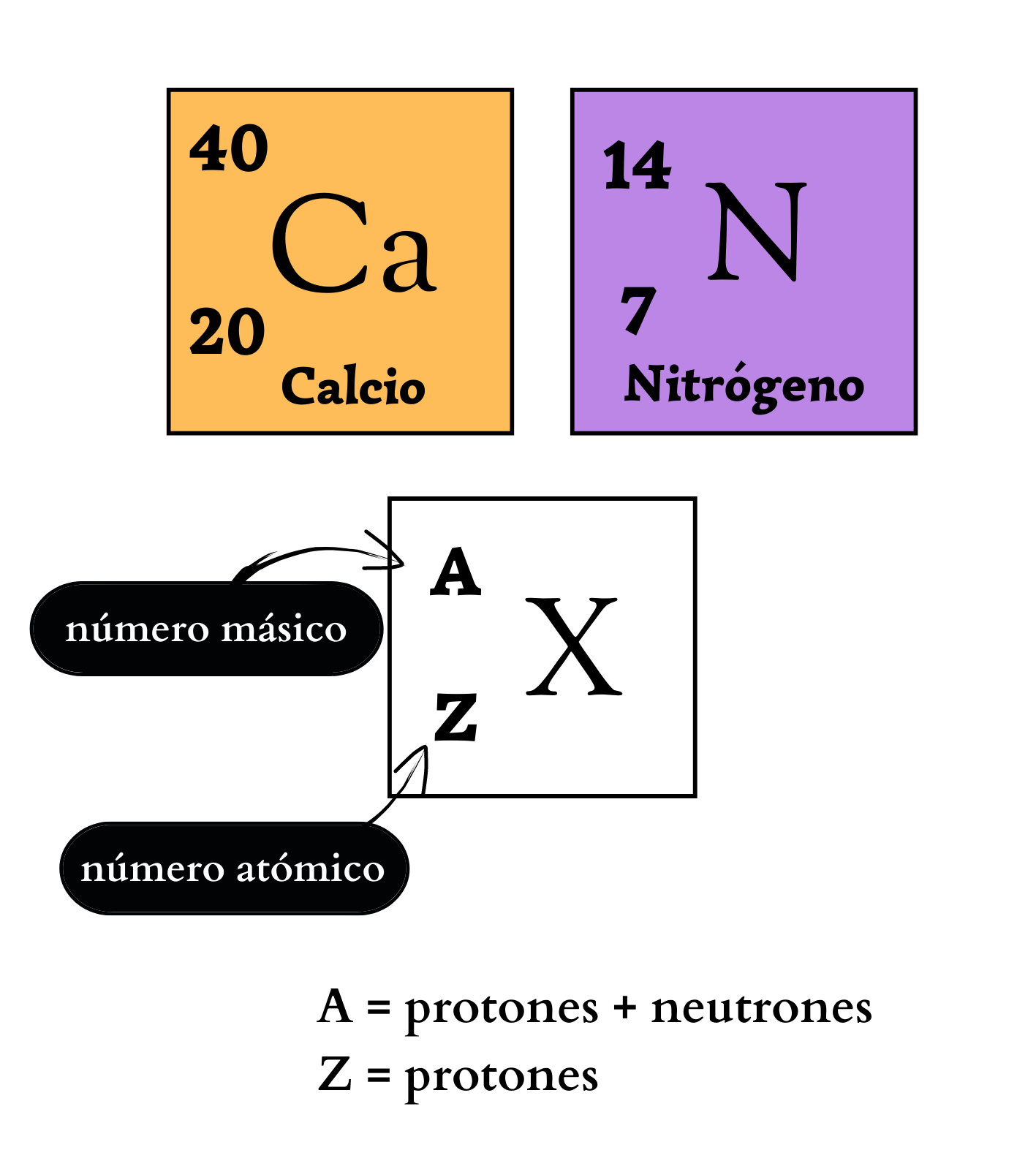
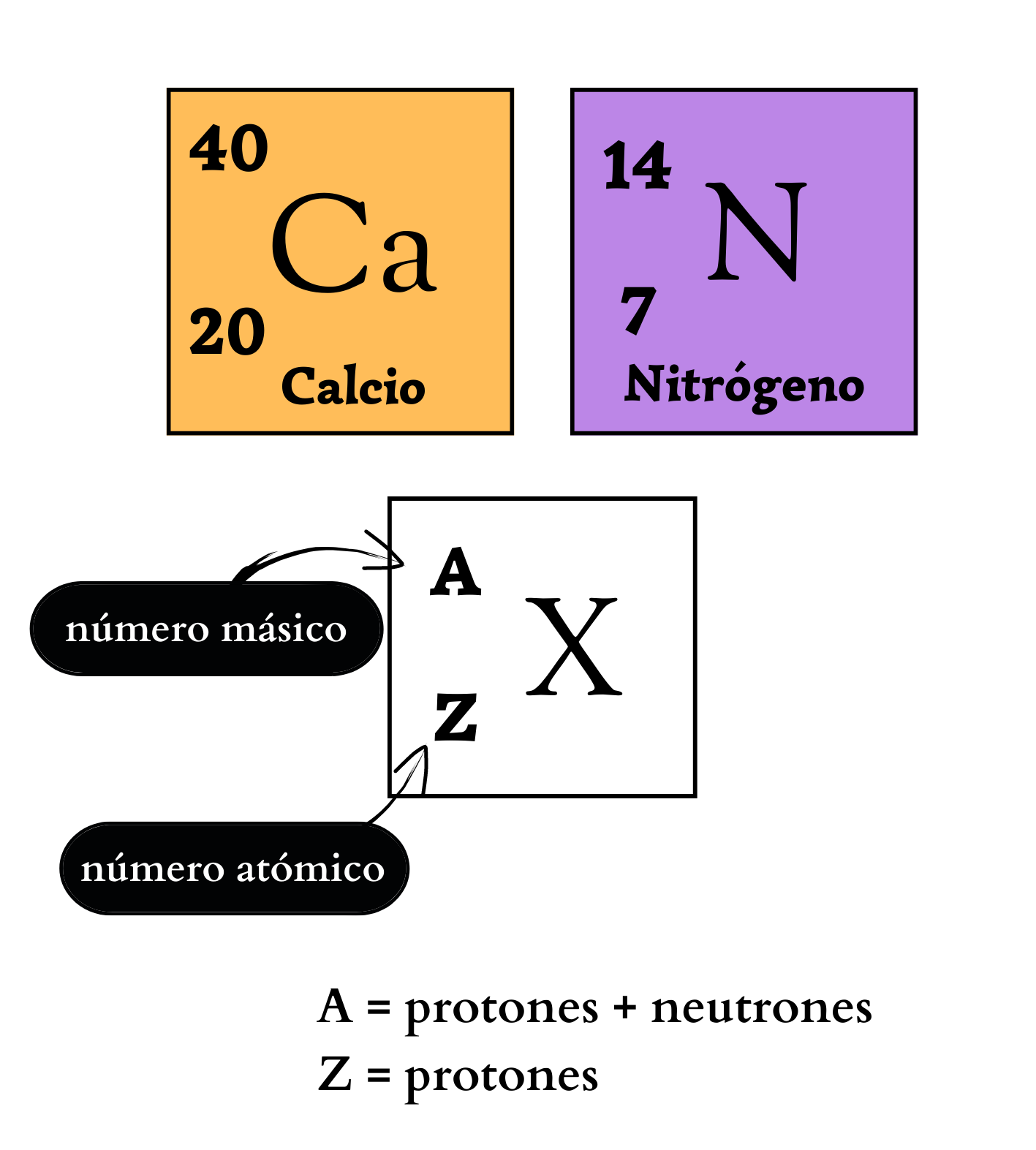
Número AtómicoEl
número atómico indica la cantidad de protones
que
tiene un átomo
de
un elemento
en
el núcleo. El número atómico define al elemento. Por ejemplo, todos los átomos del elemento nitrógeno tienen número atómico igual a 7, por lo que poseen 7 protones en su núcleo. En cambio, todos los átomos del elemento calcio tienen número atómico igual a 20, por lo que poseen 20 protones en su núcleo.
 |
Número MásicoEl
número másico de un átomo
indica
la cantidad de protones
y
neutrones
que
tiene el núcleo
atómico. El número másico se simboliza con la letra A y se coloca a la izquierda y arriba del símbolo químico del elemento. Por ejemplo, los átomos más abundantes del elemento nitrógeno se simbolizan como 14N, poseen 7 protones y 7 neutrones. Los átomos de un mismo elemento con diferente número másico se llaman isótopos. Los isótopos tienen igual número de protones pero diferente número de neutrones. Por ejemplo, el elemento nitrógeno posee dos isótopos. Un isótopo, 14N, tiene átomos con 7 protones y 7 neutrones. El otro isótopo, 15N tiene átomos con 7 protones y 8 neutrones.
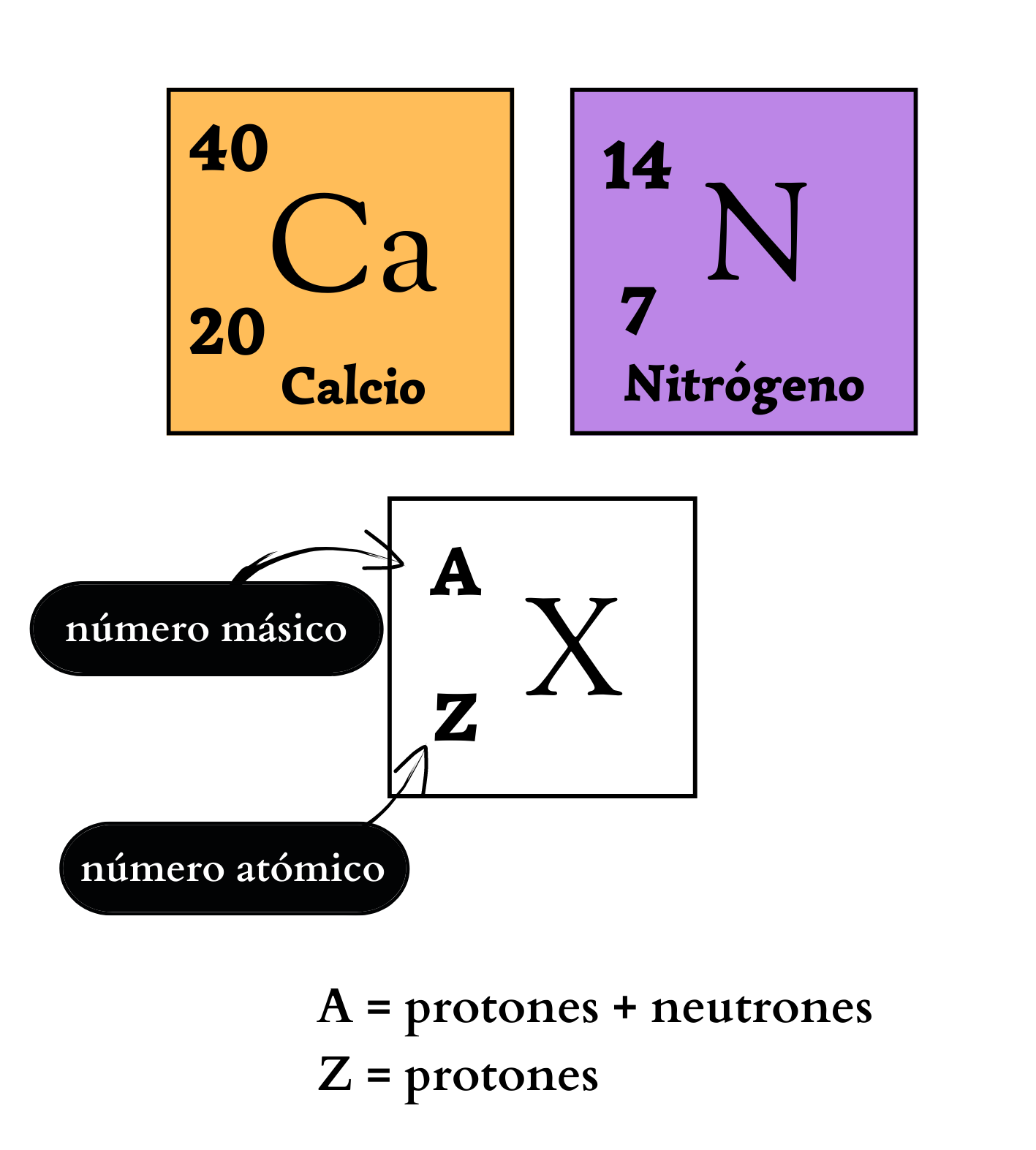 |
O |
|---|
Orbital atómico
Orbital atómico Un orbital atómico es un orbital asociado a un átomo. Algunos tipos de orbitales atómicos son los orbitales s y los orbitales p. 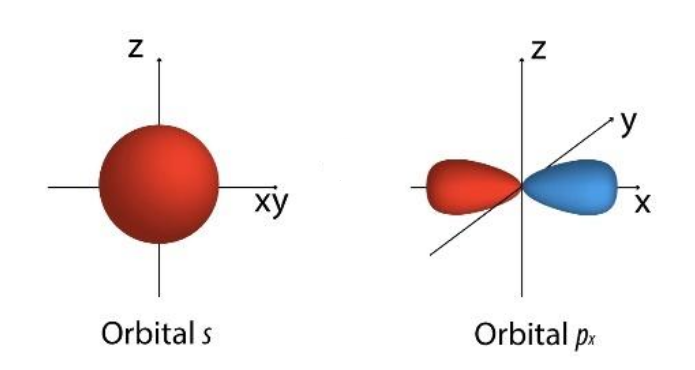 |
Orbital Molecular |
P |
|---|
PartículaLa partícula es un fragmento pequeño de materia. Algunas partículas, son tan pequeñas que no podemos verlas a simple vista. Ejemplos: átomos y moléculas.
|
Periferia AtómicaLa periferia atómica es la zona del átomo que rodea al núcleo atómico. En la periferia atómica se encuentran los electrones. La periferia atómica tiene una región interna, más cercana al núcleo. La periferia atómica tiene una región externa más alejada del núcleo. En la región interna están los electrones internos del átomo. En la región externa de la periferia están los electrones de valencia del átomo. Los electrones de valencia son los electrones que participan en el enlace químico.
|
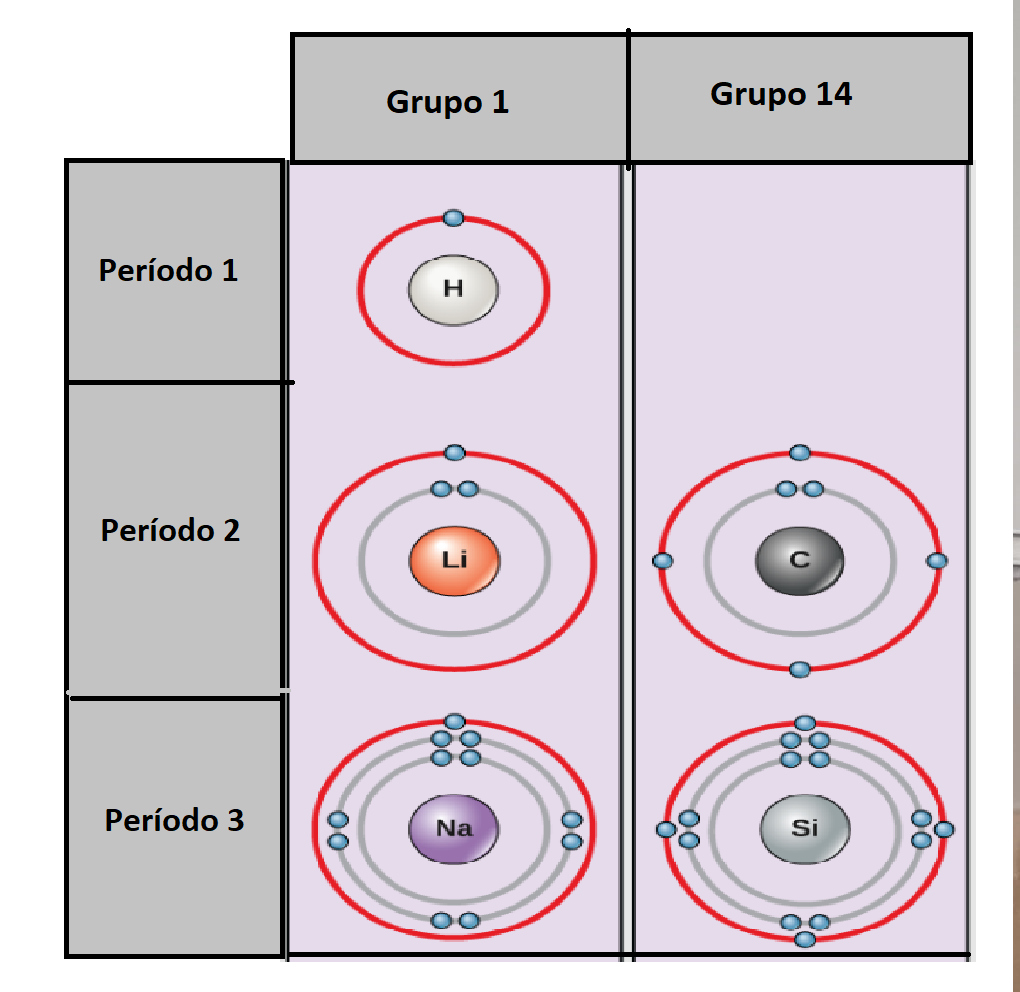
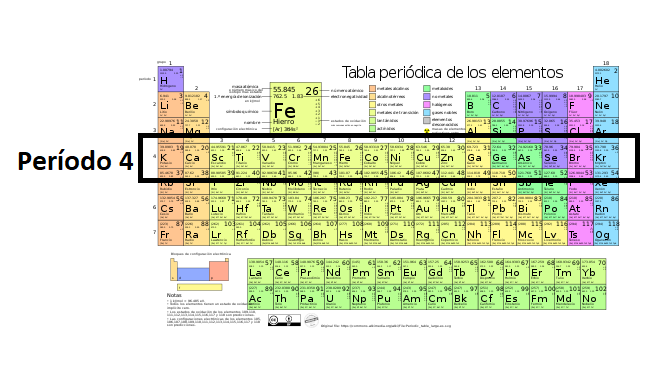
Período en la Tabla PeriódicaLos
períodos son las filas de la tabla periódica. La tabla
periódica
tiene
7 períodos.
|
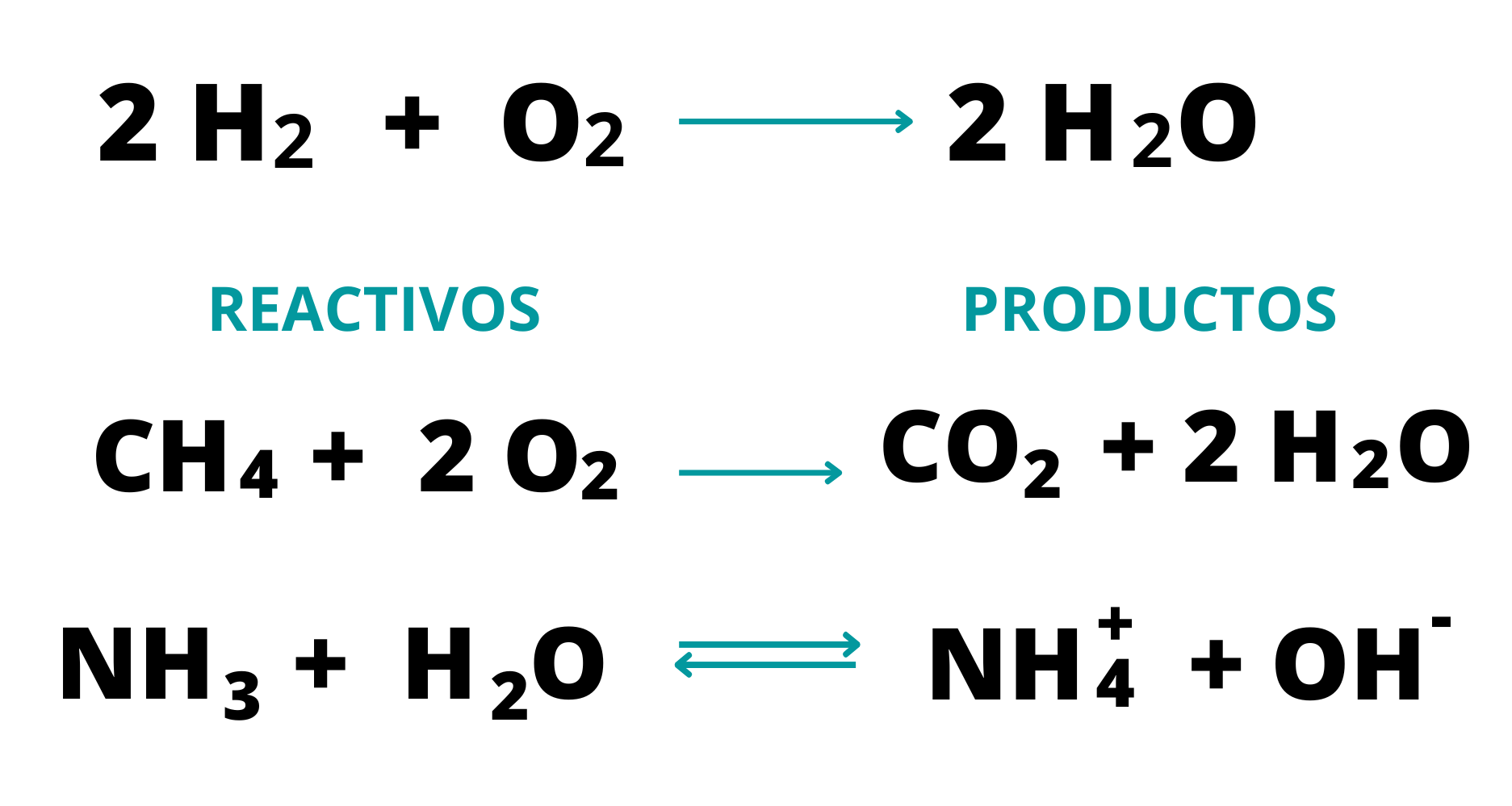
ProductosLos
productos son las sustancias
que
se obtienen en una
reacción
química. Los productos aparecen a la derecha de la flecha en una ecuación química.  |
Propiedades QuímicasLas
propiedades químicas describen la forma en que una sustancia
puede
cambiar o reaccionar para formar otras sustancias. Ejemplos:
|
ProtónUn protón es una partícula de carga positiva. El protón se encuentra
en el núcleo
del
átomo. La cantidad de protones en el núcleo define al elemento. Por ejemplo, todos los átomos del elemento nitrógeno poseen 7 protones en su núcleo. En cambio, todos los átomos del elemento calcio poseen 20 protones en su núcleo.
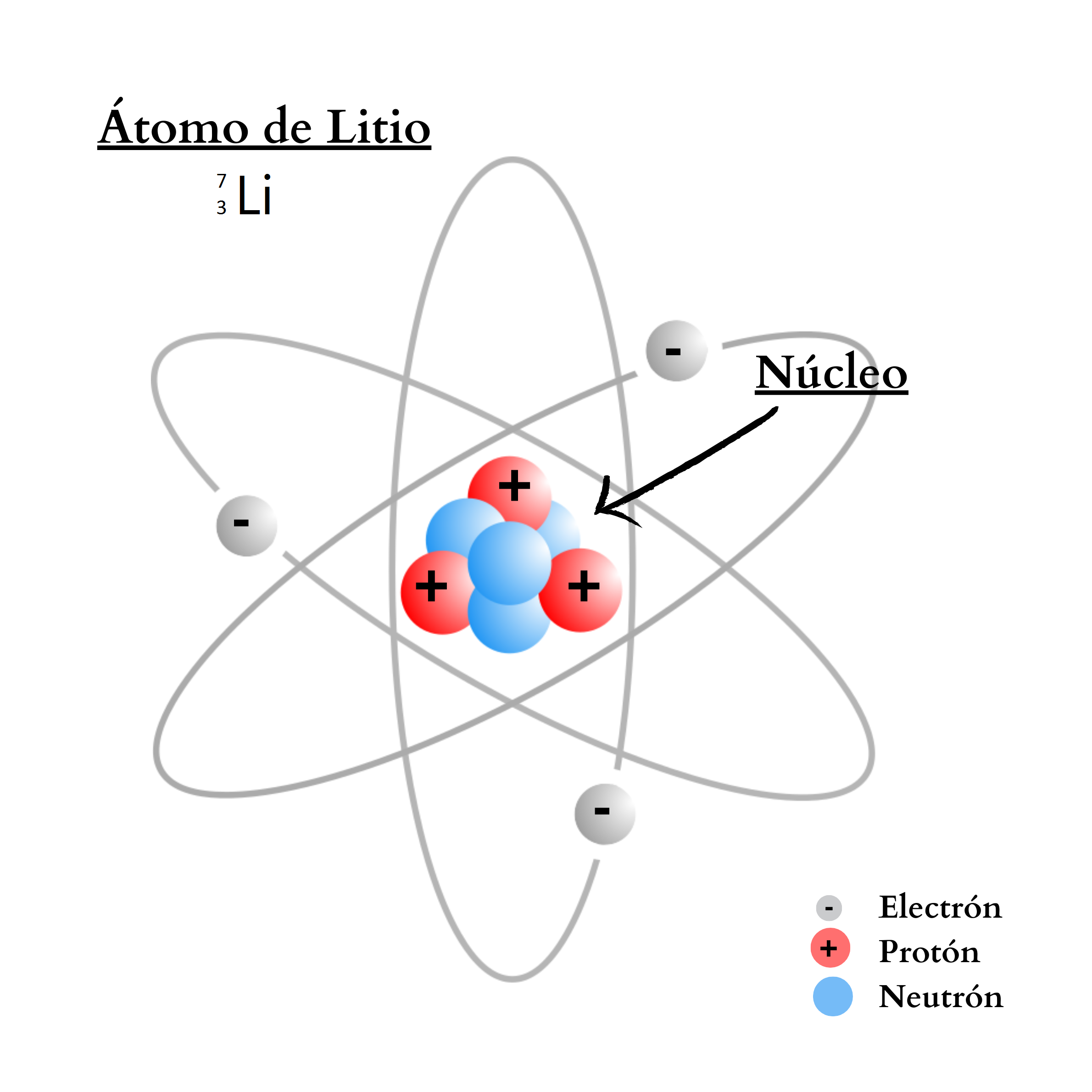 |
Puente de HidrógenoEl
puente de Hidrógeno es la denominación antigua del enlace
de Hidrógeno.
|
R |
|---|
Reacción química |
ReactivosLos
reactivos son las sustancias
de
partida en una reacción
química. Los reactivos aparecen a la izquierda de la flecha en una ecuación química.  |
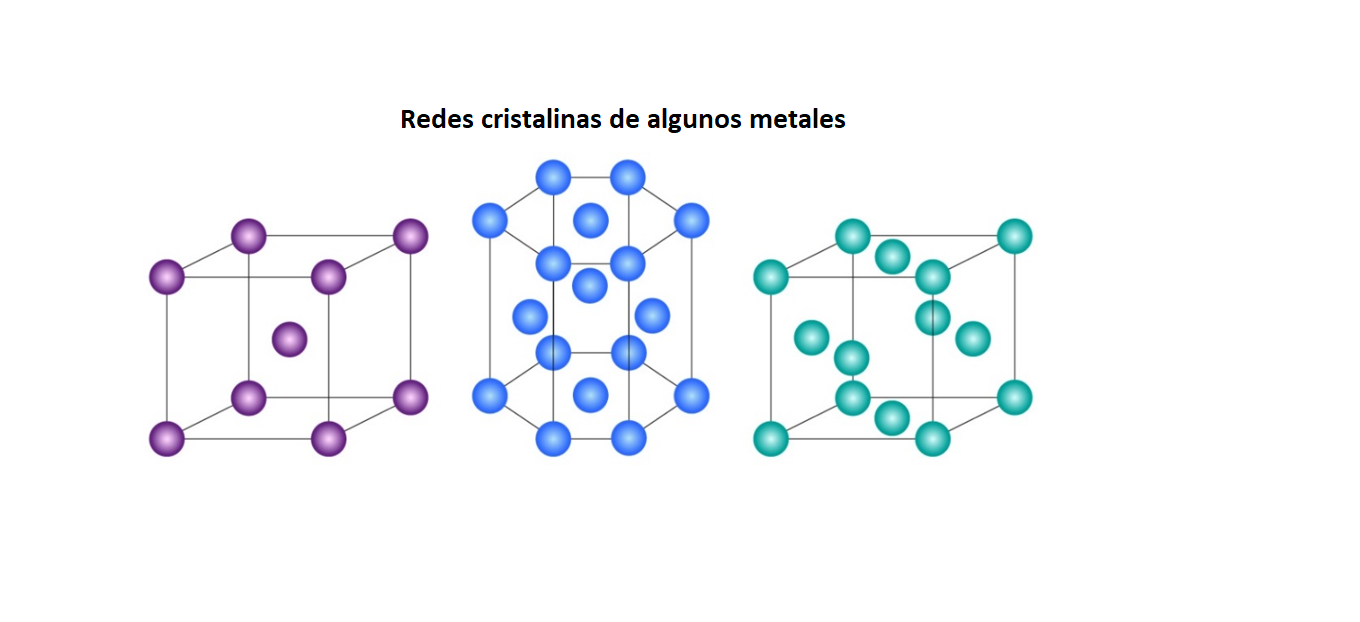
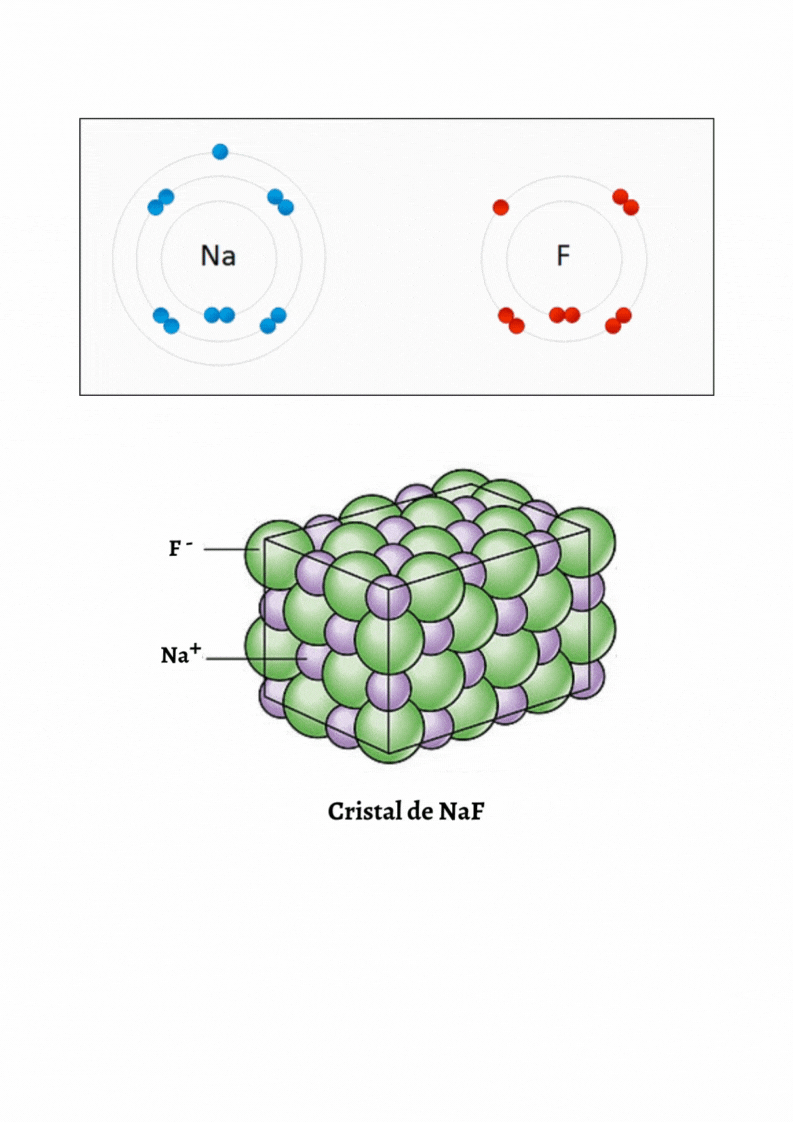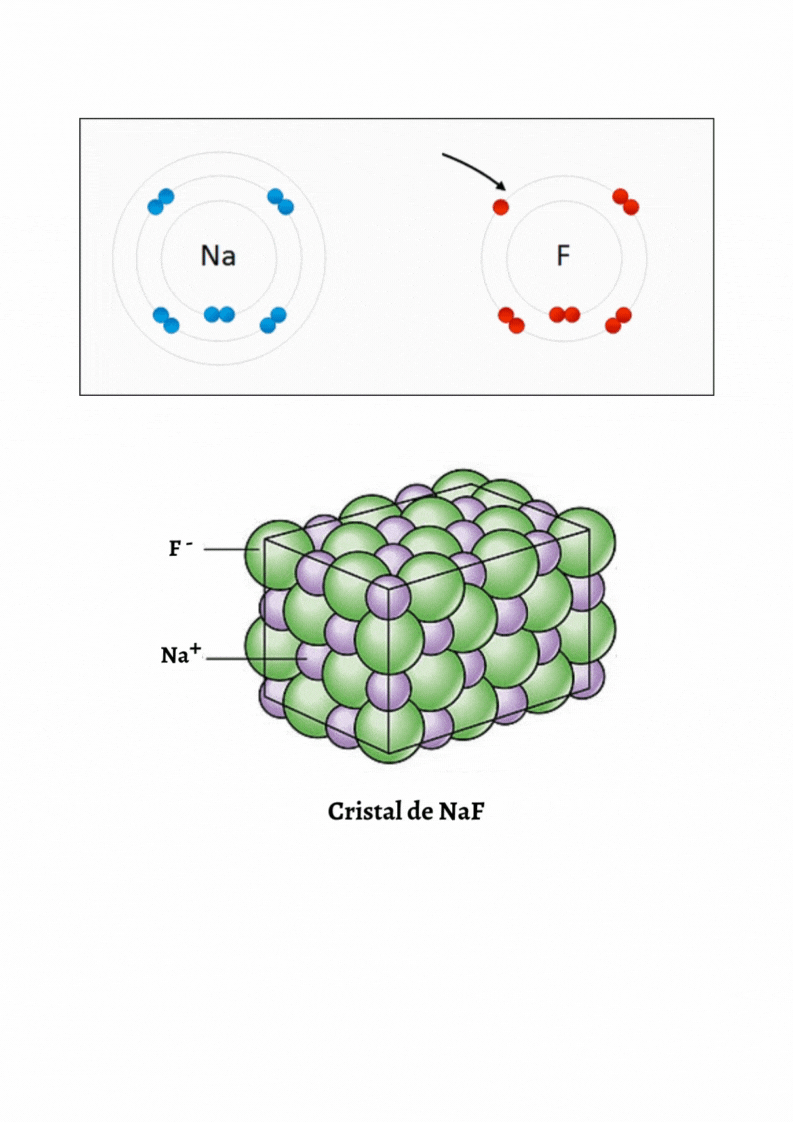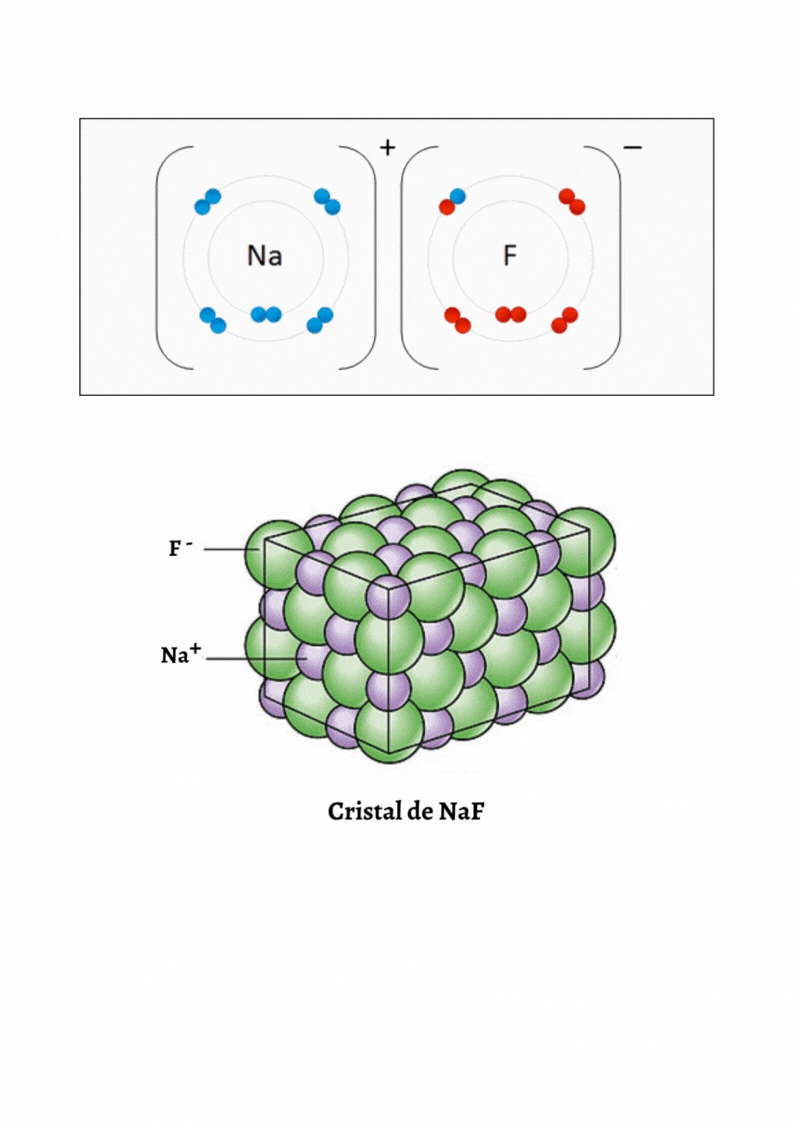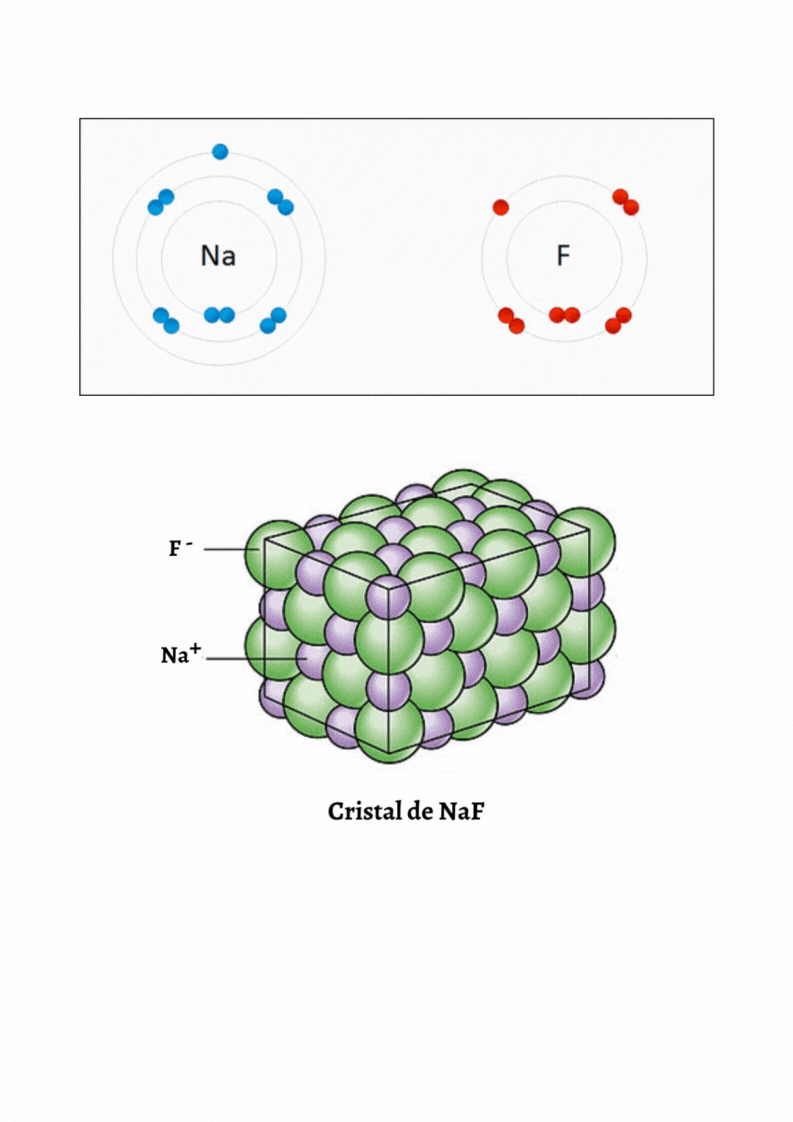
Red CristalinaUna
red cristalina es un sólido
formado
por átomos,
iones
o
moléculas. Los átomos, iones o moléculas de la red cristalina están ordenados en el espacio de forma repetida. Un ejemplo de red cristalina son los metales.
|
S |
|---|
Símbolo QuímicoEl
símbolo químico es una forma de representar a un elemento
químico
con
letras. Cada elemento químico se representa con un símbolo químico formado por una letra mayúscula o por dos letras, una mayúscula y una minúscula. Por ejemplo, el elemento nitrógeno se representa como N, y el elemento calcio como Ca. El símbolo químico, además de las letras, puede incluir el número másico y el número atómico. Cada elemento químico se compone de un solo tipo de átomo.
|
SistemaUn
sistema es la porción del Universo que nos interesa estudiar Algunos ejemplos de sistemas son:
|
Sistema Heterogéneo |
Sistema Homogéneo |
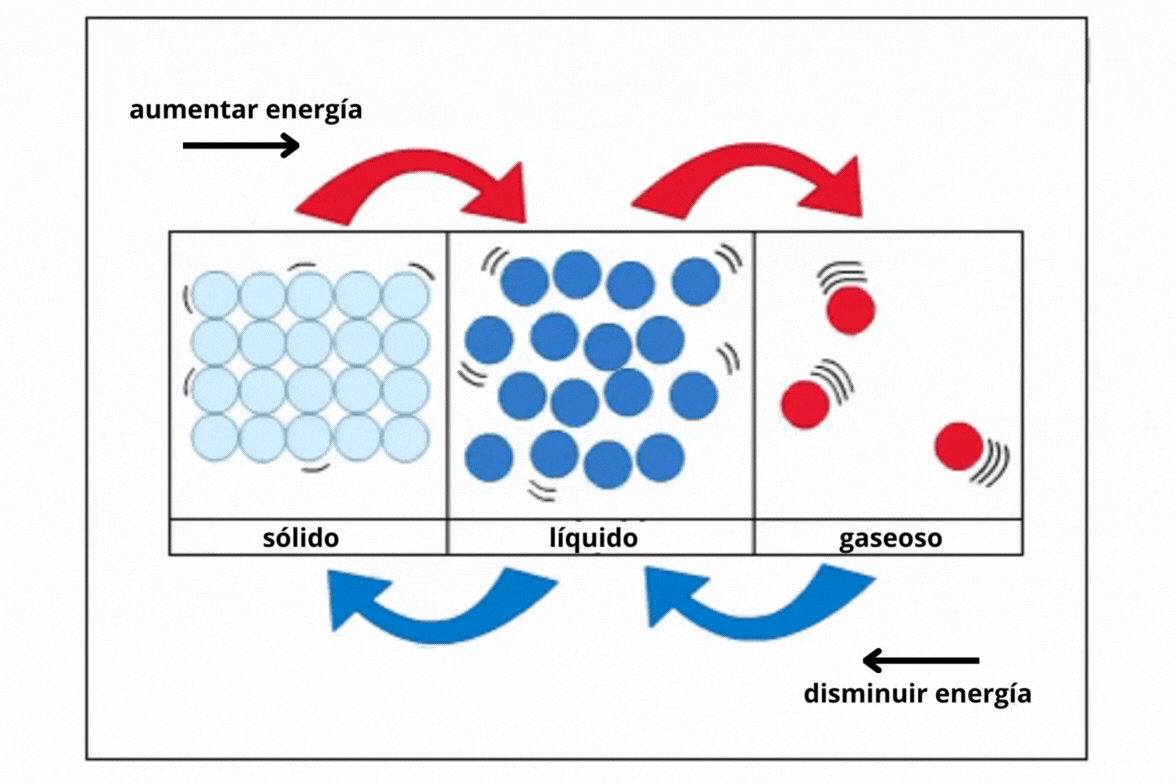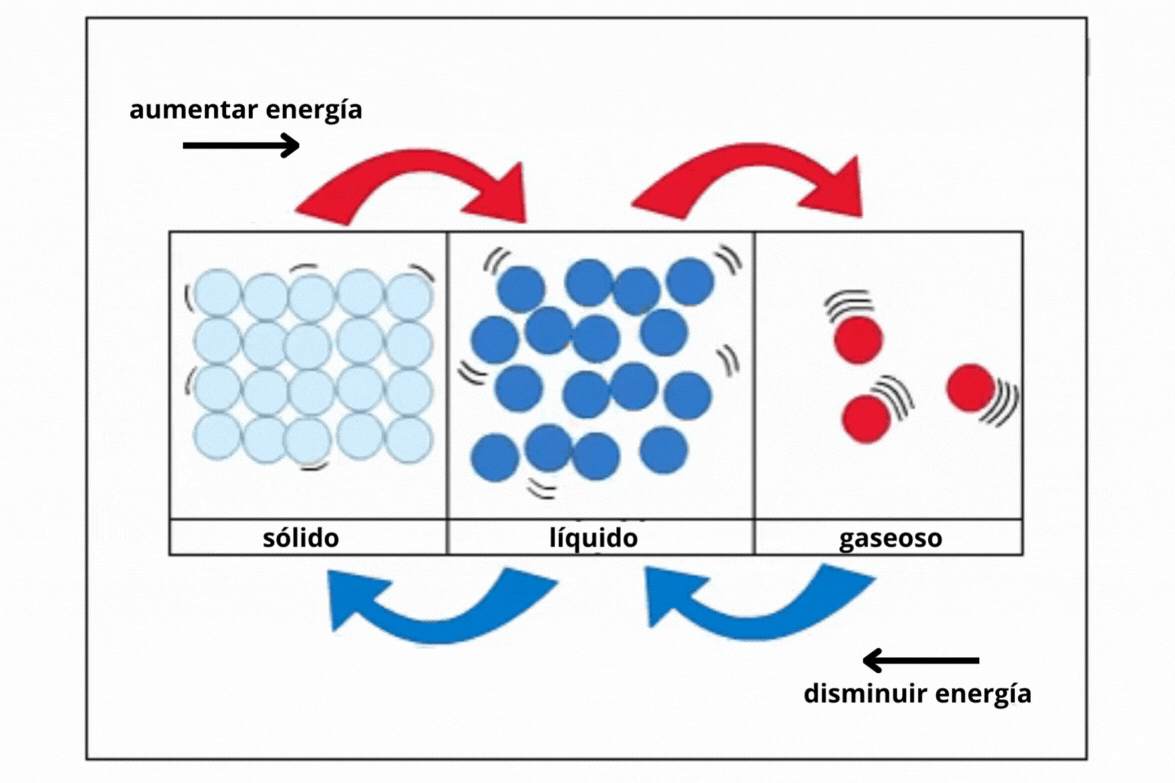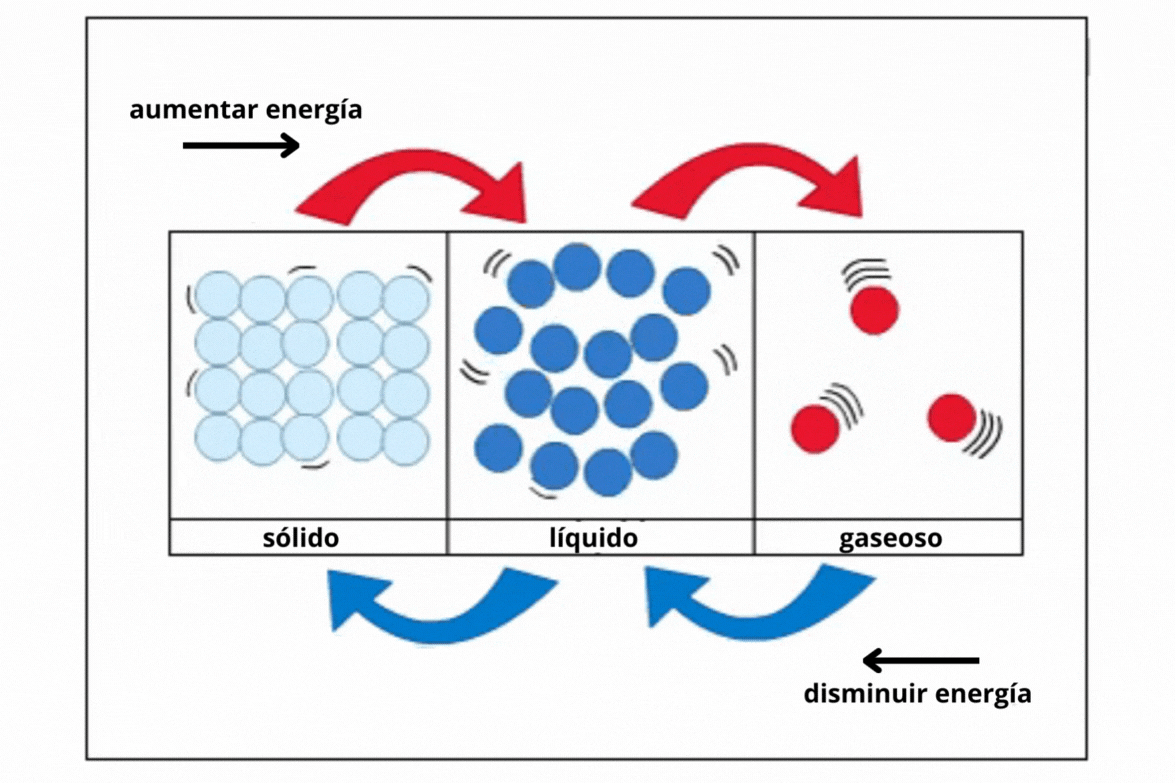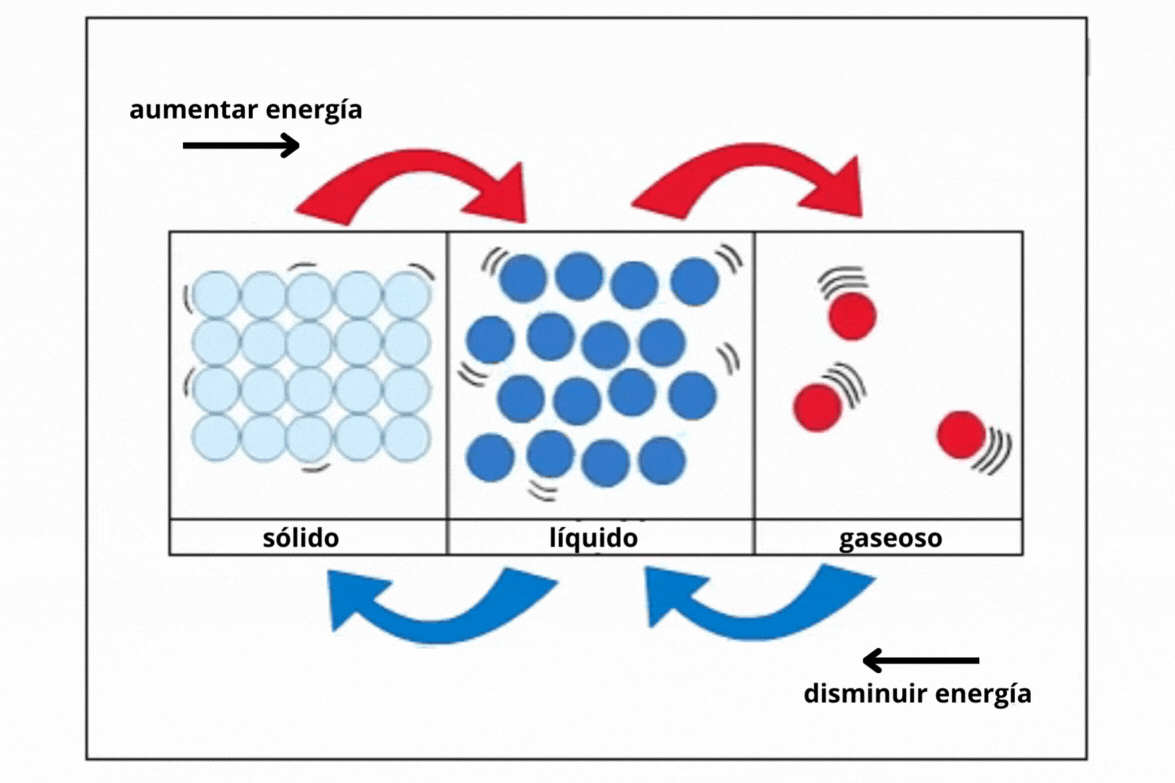
Sólido |
SolutoEs
una sustancia disuelta en un disolvente
para
formar una disolución. En general el soluto está en menor proporción que el disolvente. 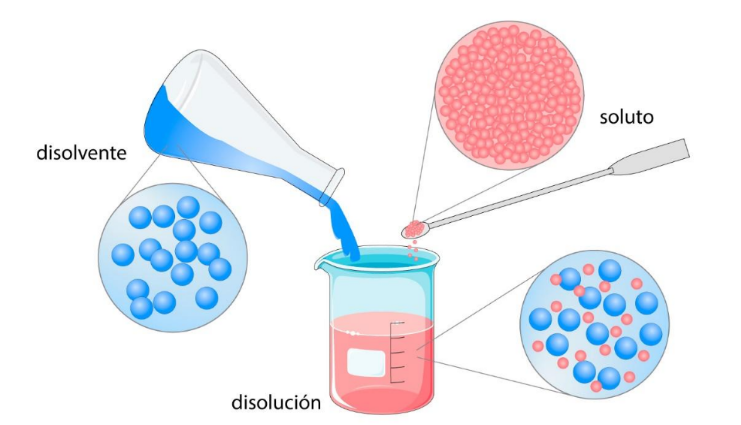 |
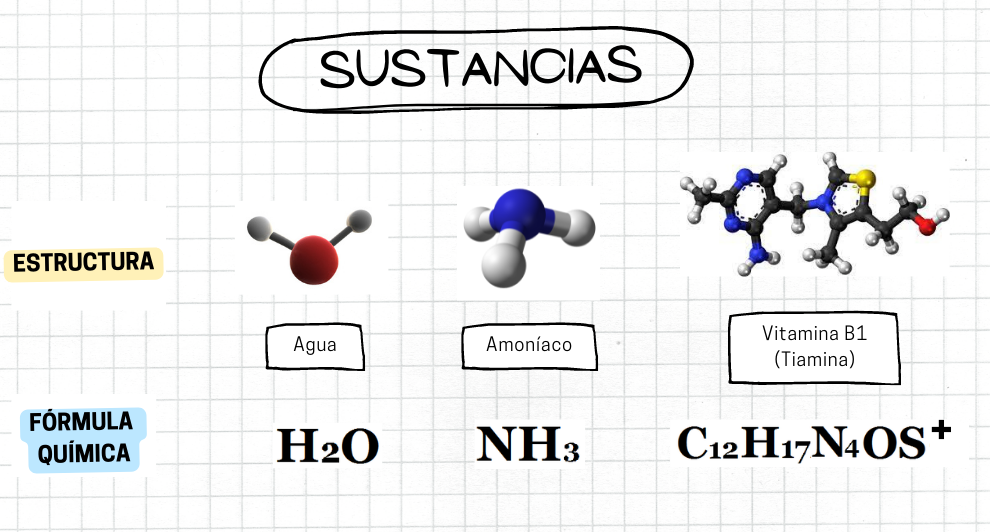
SustanciaLa sustancia es un tipo de materia que tiene composición fija y propiedades definidas. Si se modifica la composición química de una sustancia se transforma en una nueva sustancia. Un sistema que contiene dos o más sustancias es una mezcla
|
SUSTANCIA IÓNICA |
T |
|---|
Tabla Periódica de los Elementos QuímicosLa
tabla periódica es una forma de organizar los elementos
químicos. En la tabla periódica los elementos químicos se encuentran ordenados por su número atómico y por sus propiedades químicas. La tabla periódica está compuesta por casillas ordenadas en filas y columnas. Las filas son llamadas períodos y las columnas son llamadas grupos. En cada casilla se representa un elemento químico con su símbolo químico e información del elemento químico.
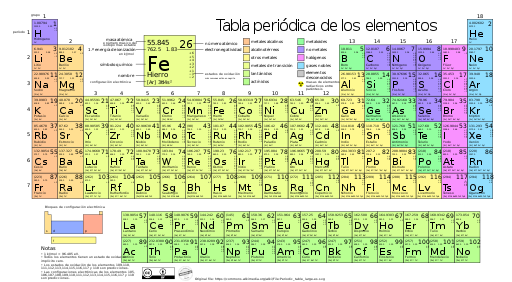 |
V |
|---|
VolumenEl volumen es la medida del espacio que ocupa un objeto. En el Sistema Internacional, la unidad de medida del volumen es el metro cúbico (m3) y 1 m3 = 1000 L
|