GLOSARIO DE QUÍMICA
GLOSARIO DE QUÍMICA
| Todas las categorías |
MEDICIÓN |
|---|
Magnitud |
Masa |
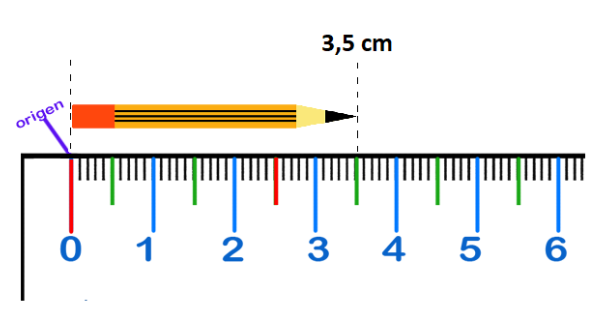
MediciónLa
medición es el proceso de comparar una cantidad desconocida que
queremos determinar con una cantidad conocida de la misma magnitud,
que se usa como referencia o unidad. Al resultado del proceso de medición se le llama medida. |
Medida |
VolumenEl volumen es la medida del espacio que ocupa un objeto. En el Sistema Internacional, la unidad de medida del volumen es el metro cúbico (m3) y 1 m3 = 1000 L
|
SISTEMA |
|---|
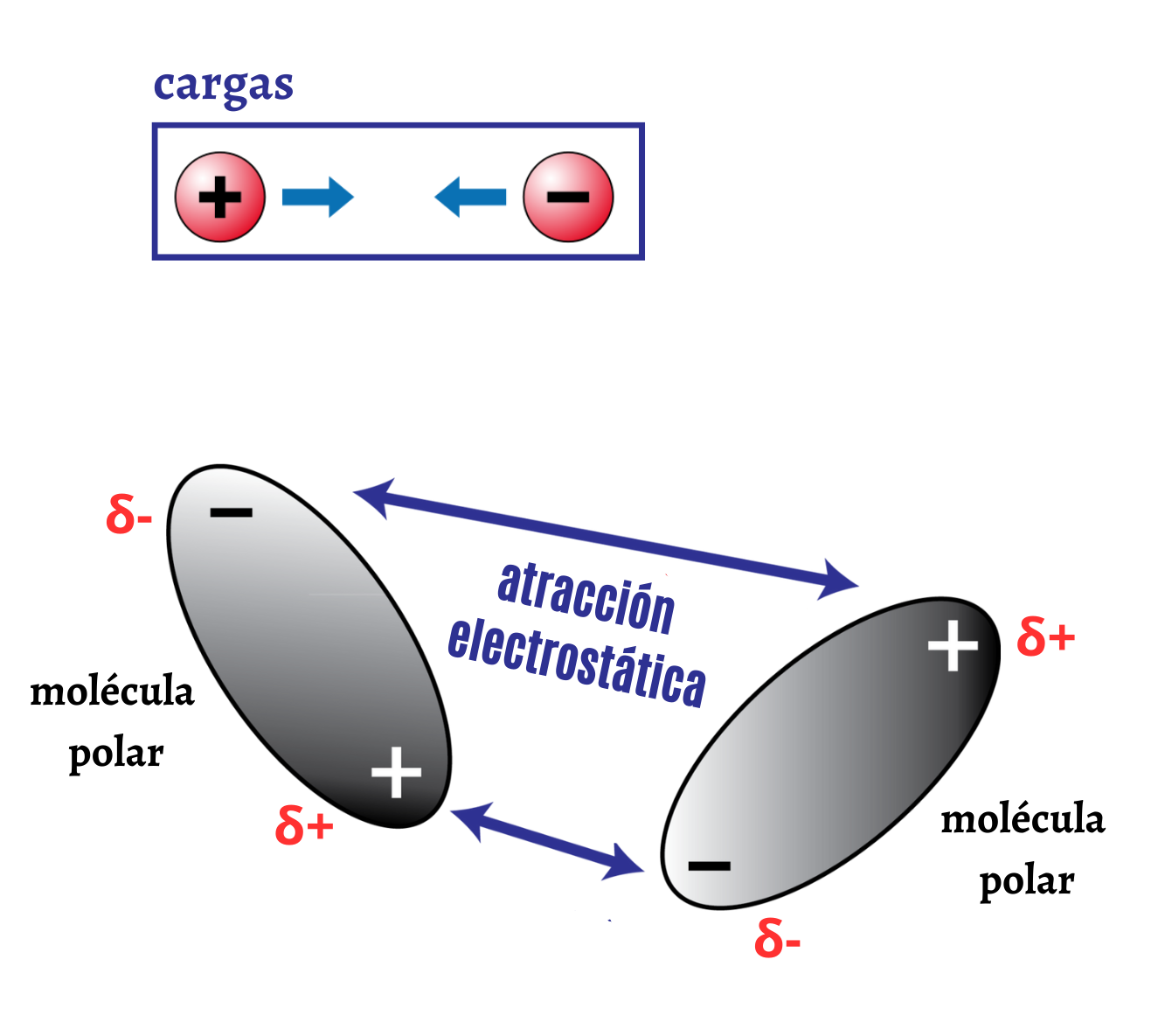
Atracción ElectrostáticaLa atracción electrostática es la interacción entre cargas eléctricas de signo opuesto. La atracción electrostática hace que las cargas de signo opuesto se atraigan. En el caso de moléculas polares la atracción electrostática se establece entre cargas parciales de signo opuesto.
 |
CompuestoUn
compuesto es una sustancia
formada
por dos o más elementos Un ejemplo de compuesto es el agua (H2O), que está compuesta por los elementos químicos hidrógeno y oxígeno. |
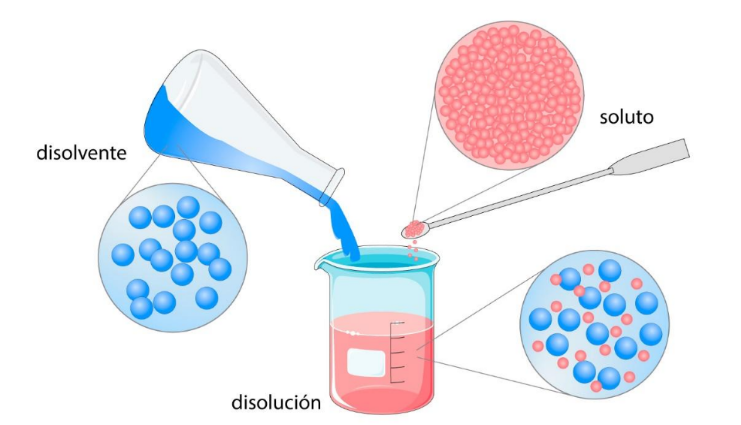
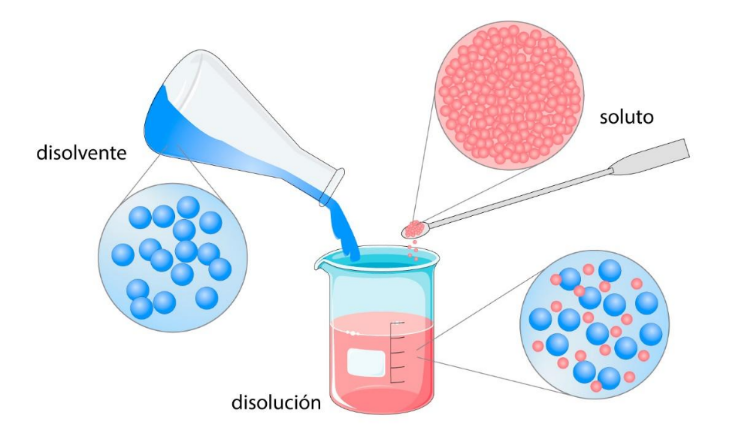
Disolución o Solución |
Disolvente o Solvente |
Fase |
MezclaUna mezcla es un tipo de materia que está formada por dos o más sustancias. En una mezcla, cada sustancia conserva su composición química. Las sustancias tienen composición química fija. En cambio, la composición de una mezcla puede variar. Existen dos tipos de mezclas: las mezclas homogéneas y las mezclas heterogéneas.
|
Mezcla Heterogénea |
Mezcla Homogénea |
SistemaUn
sistema es la porción del Universo que nos interesa estudiar Algunos ejemplos de sistemas son:
|
Sistema Heterogéneo |
Sistema Homogéneo |
SolutoEs
una sustancia disuelta en un disolvente
para
formar una disolución. En general el soluto está en menor proporción que el disolvente. 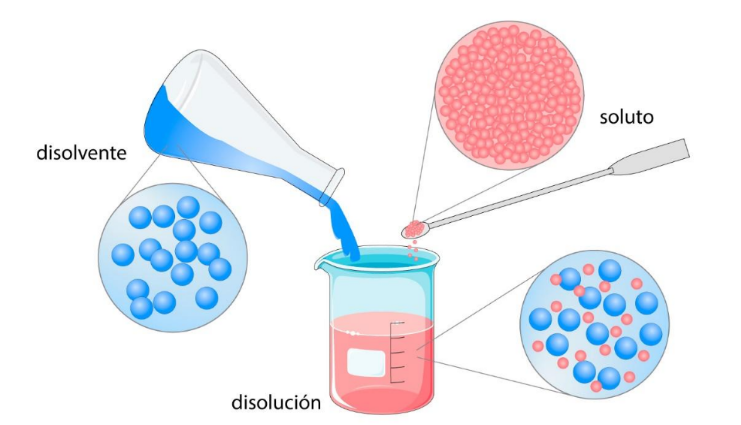 |
TRANSFORMACIONES DE LA MATERIA |
|---|
Cambio FísicoUn
cambio físico es una transformación en la que no se modifica la
composición
química
de
las sustancias. Un ejemplo de cambio físico es la transformación de hielo en agua líquida. En los dos casos la sustancia es agua (H2O).
|
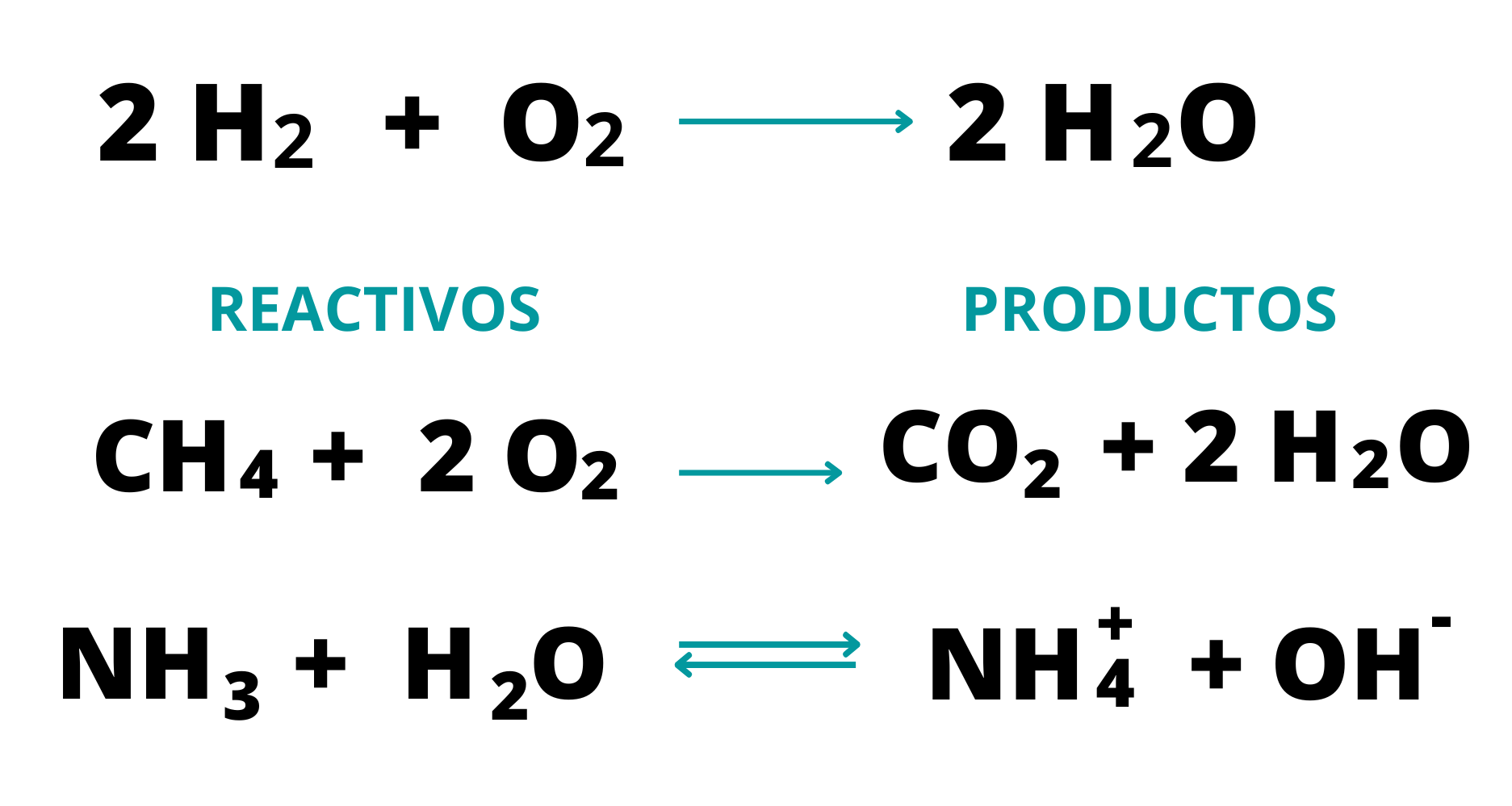
Ecuación QuímicaLa ecuación química es la representación de una reacción química. En
las ecuaciones químicas se usan las fórmulas
químicas
de
los
reactivos
y
productos Las ecuaciones químicas están balanceadas cuando la cantidad de átomos de cada elemento en los reactivos es igual a la cantidad de átomos de cada elemento en los productos Es frecuente que en las ecuaciones químicas se muestre el estado de agregación de cada sustancia.
 |
ProductosLos
productos son las sustancias
que
se obtienen en una
reacción
química. Los productos aparecen a la derecha de la flecha en una ecuación química.  |
Propiedades QuímicasLas
propiedades químicas describen la forma en que una sustancia
puede
cambiar o reaccionar para formar otras sustancias. Ejemplos:
|
Reacción química |
ReactivosLos
reactivos son las sustancias
de
partida en una reacción
química. Los reactivos aparecen a la izquierda de la flecha en una ecuación química.  |
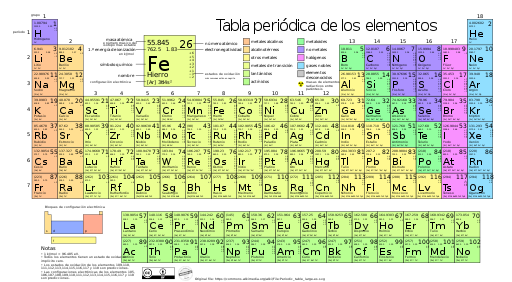
Tabla Periódica de los Elementos QuímicosLa
tabla periódica es una forma de organizar los elementos
químicos. En la tabla periódica los elementos químicos se encuentran ordenados por su número atómico y por sus propiedades químicas. La tabla periódica está compuesta por casillas ordenadas en filas y columnas. Las filas son llamadas períodos y las columnas son llamadas grupos. En cada casilla se representa un elemento químico con su símbolo químico e información del elemento químico.
 |