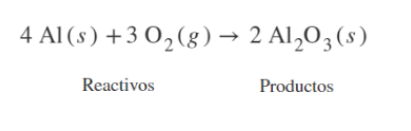GLOSARIO DE QUÍMICA
GLOSARIO DE QUÍMICA
Especial | A | B | C | D | E | F | G | H | I | J | K | L | M | N | Ñ | O | P | Q | R | S | T | U | V | W | X | Y | Z | TODAS
A |
|---|
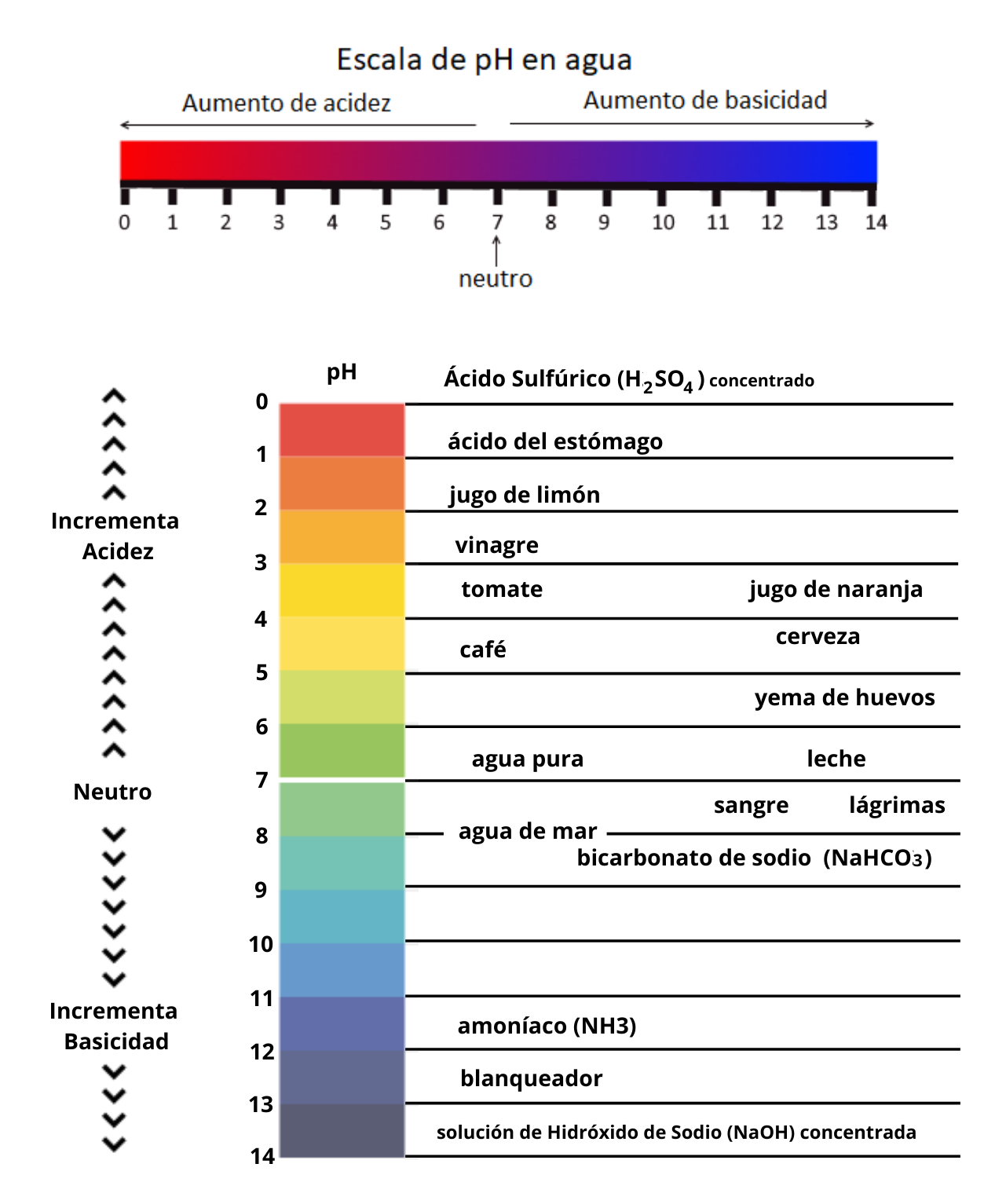
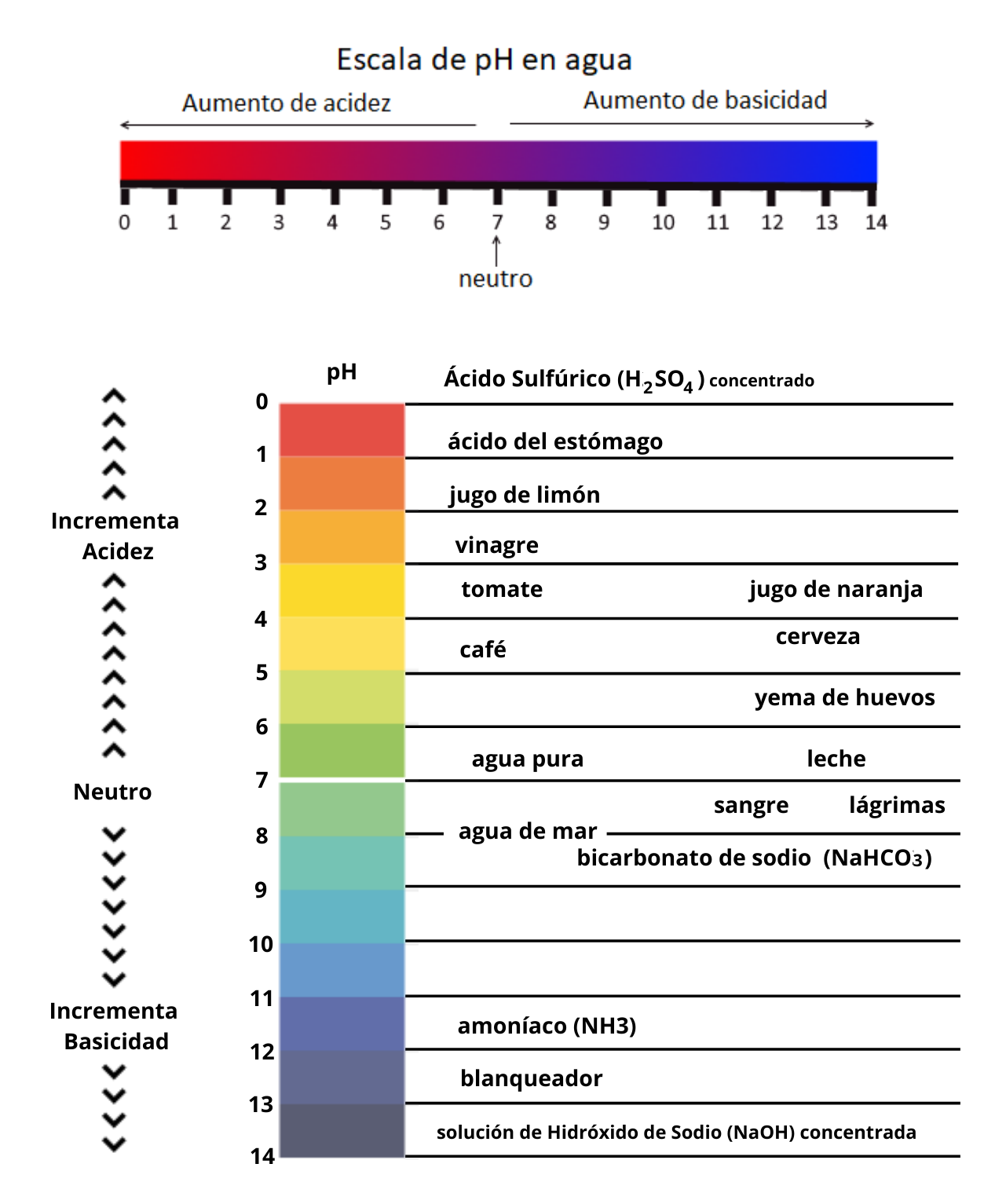
AcidezLa acidez es la tendencia de una sustancia a ceder protones a una base. La acidez es una medida de la fuerza de un ácido. Cuanto mayor es la acidez más fuerte es el ácido.
This is a modal window. No se ha podido cargar el vídeo debido a un fallo de red o del servidor o porque el formato es incompatible. |
Á |
|---|
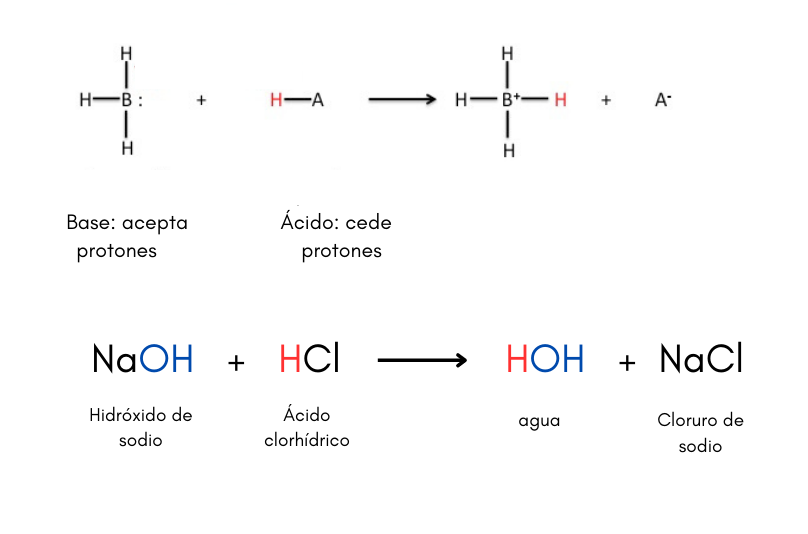
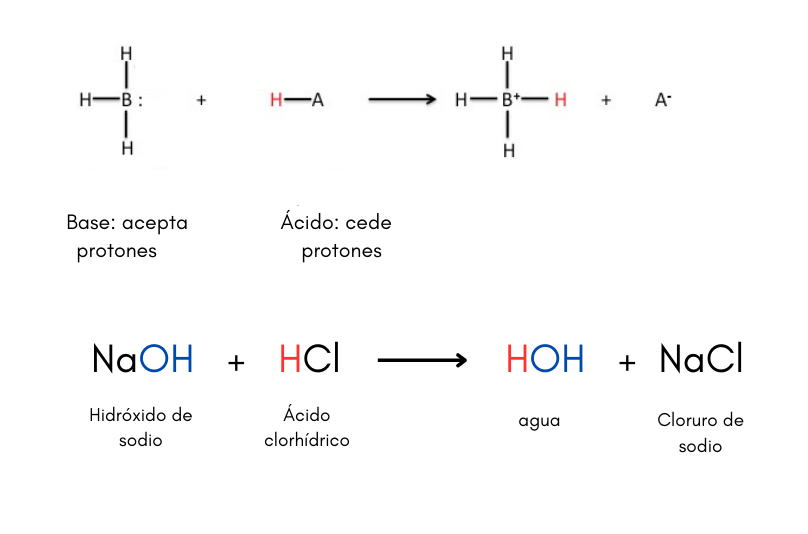
Ácido (teoría de Brönsted-Lowry)Un ácido es una sustancia que puede ceder protones a una base. Por ejemplo:
Existen otras teorías de ácidos y bases como por ejemplo la teoría de Lewis. Cuando se disuelve un ácido en agua el valor de pH de la solución es menor que 7.
This is a modal window. No se ha podido cargar el vídeo debido a un fallo de red o del servidor o porque el formato es incompatible. |
A |
|---|
Actividad (concentración efectiva)La actividad de un soluto es la concentración real de ese soluto que participa en un proceso químico. La actividad o concentración efectiva del soluto considera las interacciones entre los componentes del sistema. La actividad se define como: En soluciones diluidas el coeficiente de actividad se acerca a 1 y la actividad es similar a la concentración En soluciones diluidas el coeficiente
This is a modal window. No se ha podido cargar el vídeo debido a un fallo de red o del servidor o porque el formato es incompatible. |
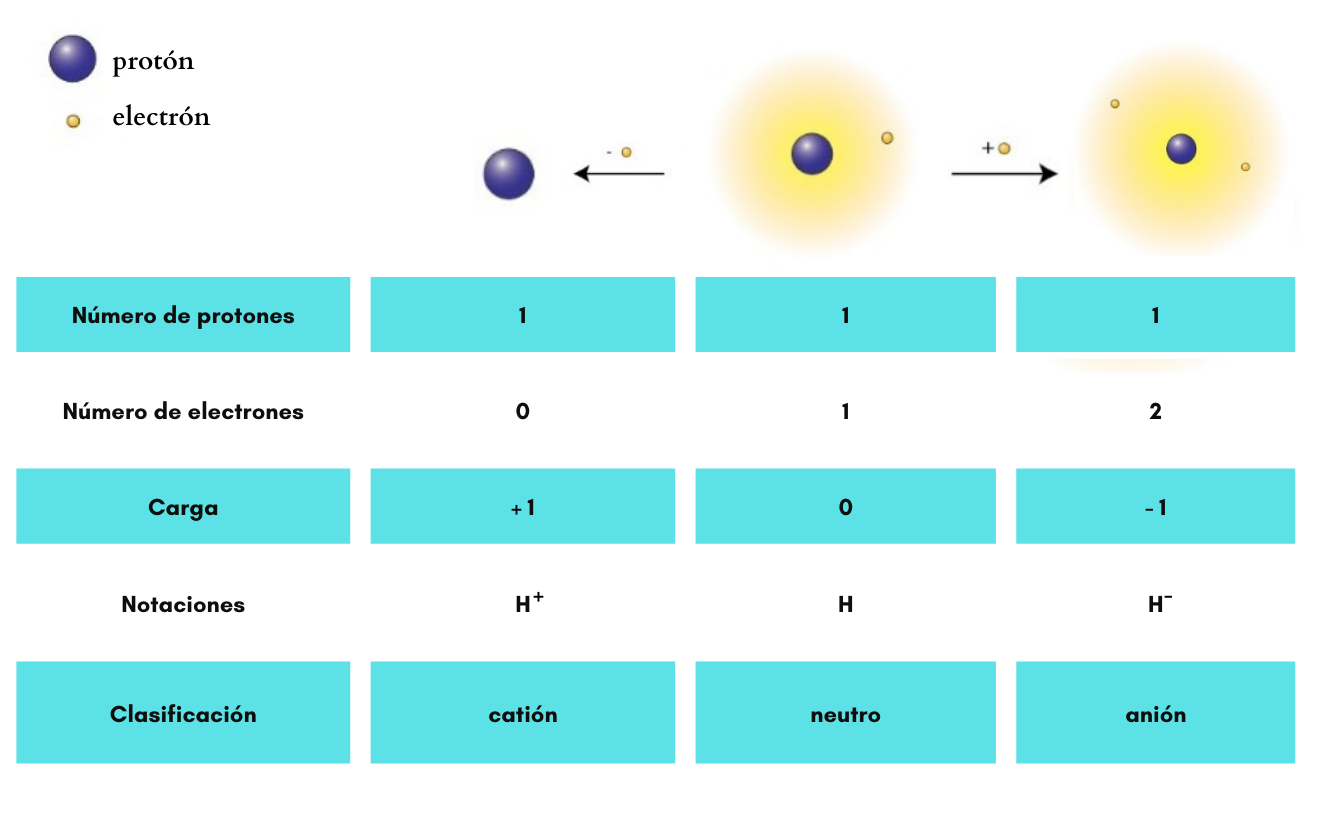
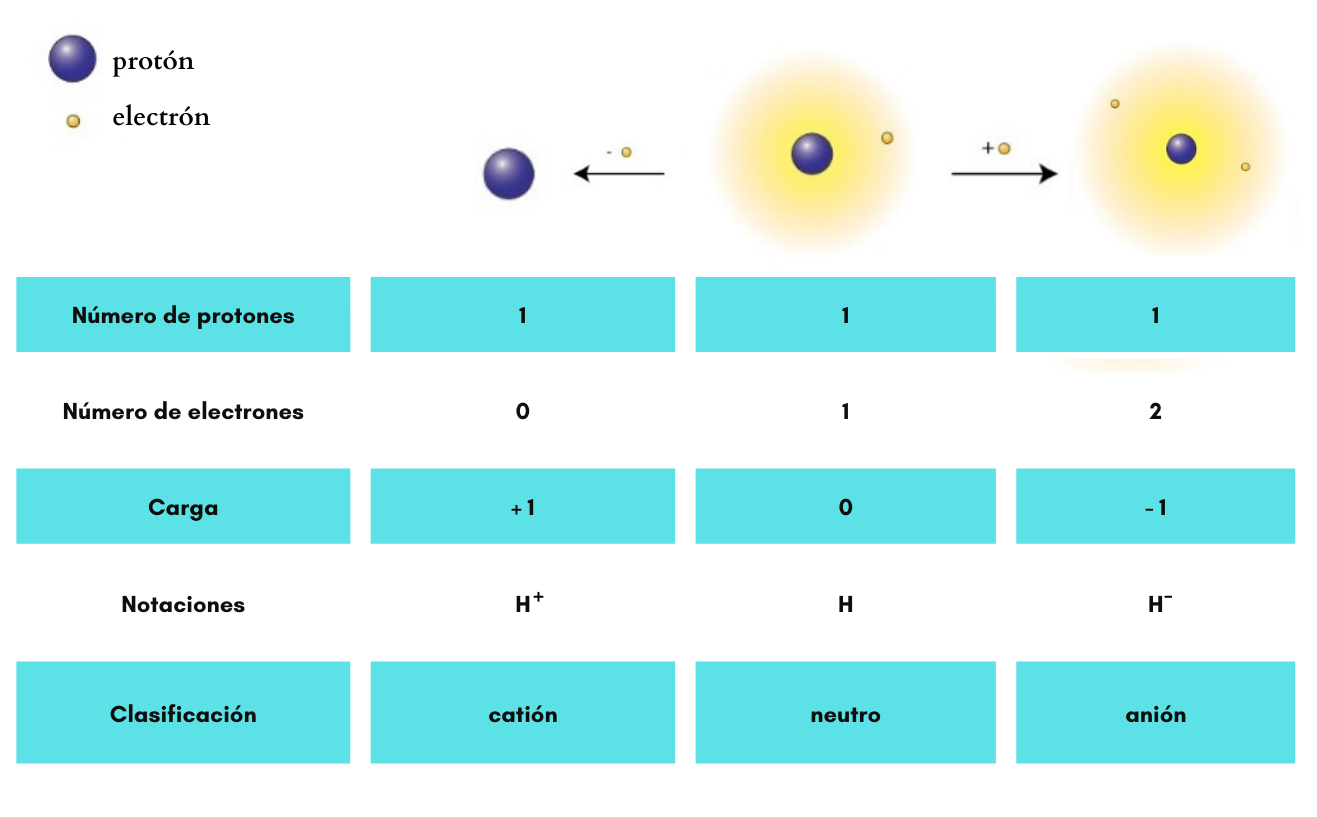
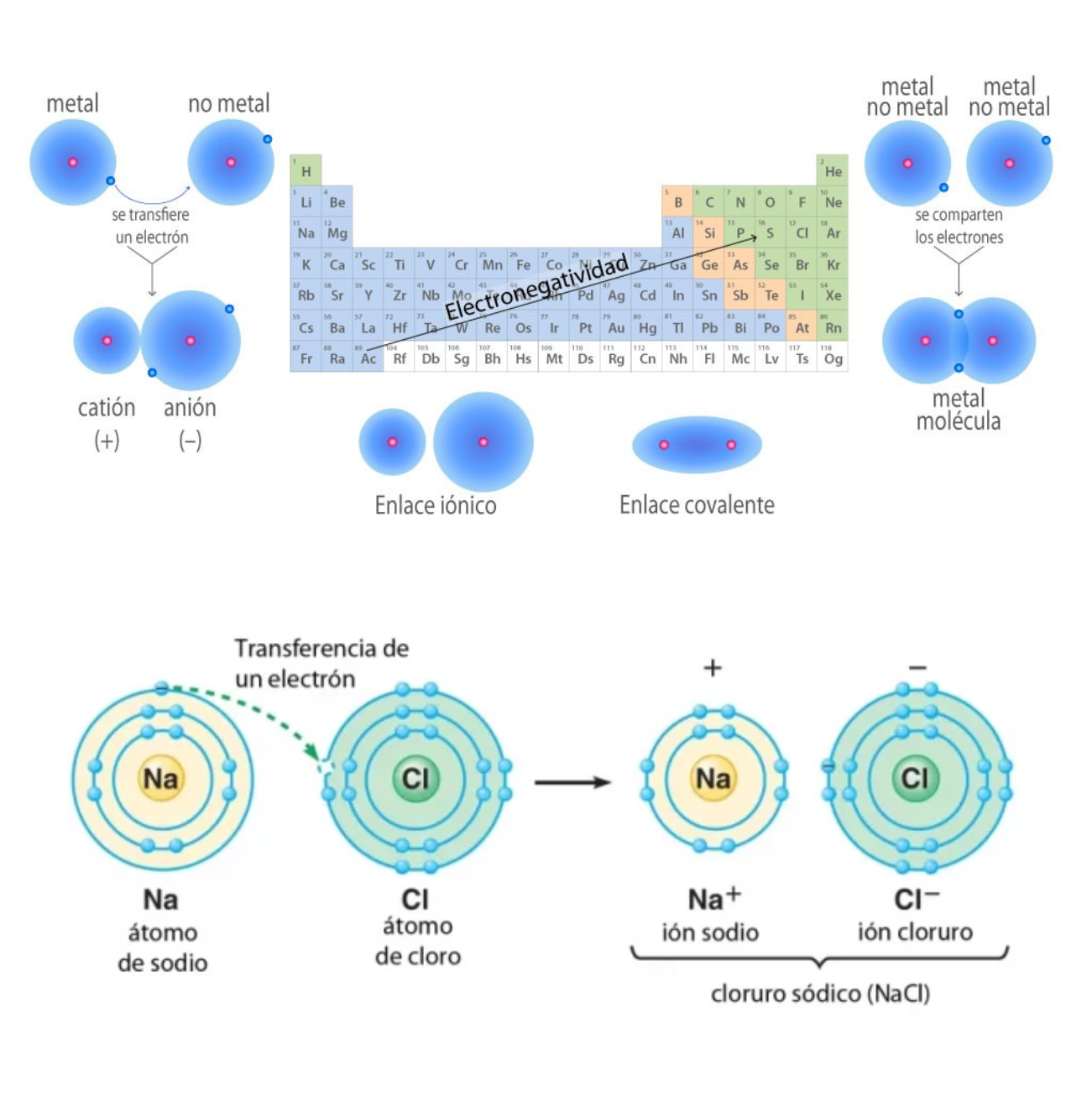
AniónUn
anión es un ion
con
carga eléctrica negativa. Ejemplos: Ejemplos: Cl- (cloruro), SO42- (sulfato), H- (anión hidruro)
This is a modal window. No se ha podido cargar el vídeo debido a un fallo de red o del servidor o porque el formato es incompatible. |
Á |
|---|
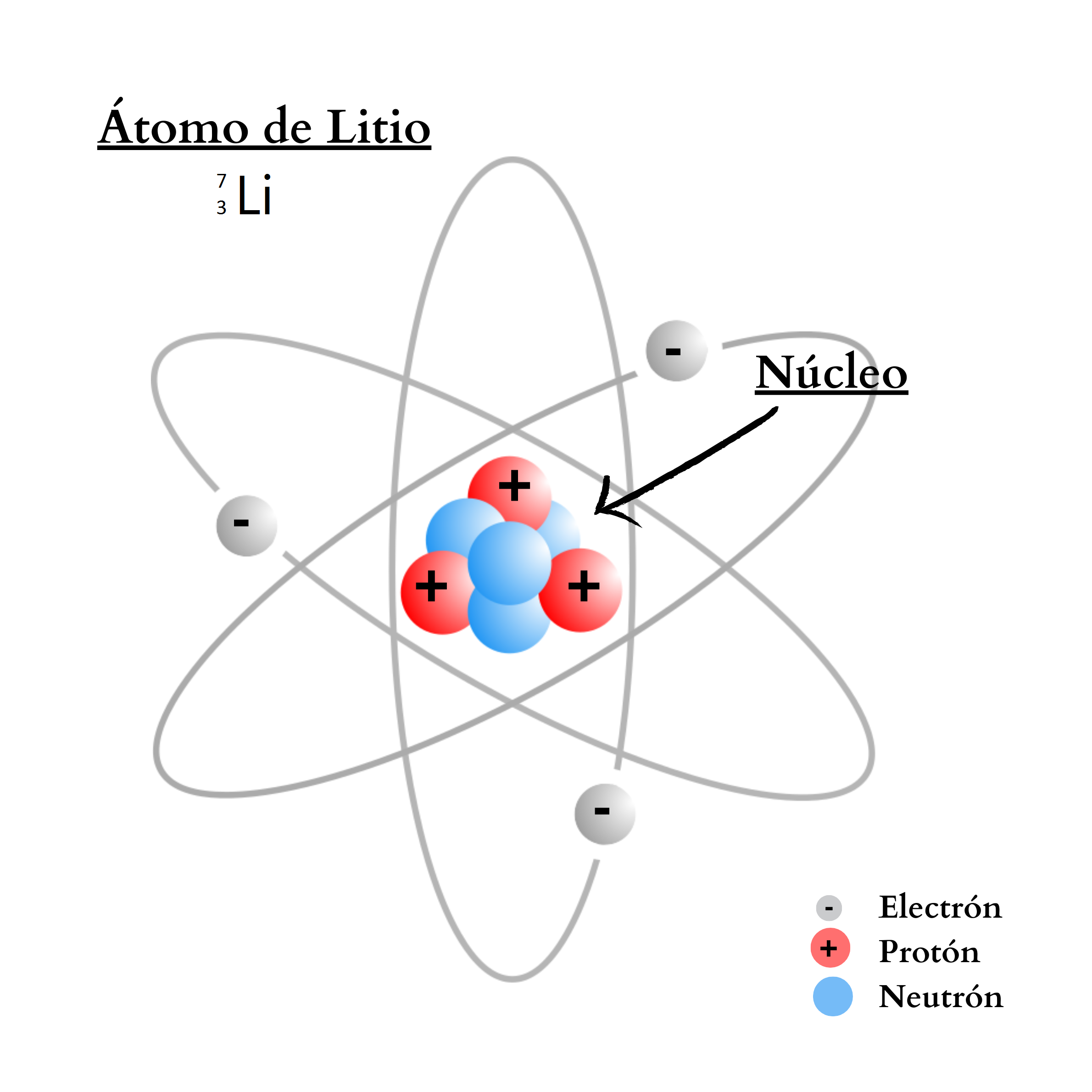
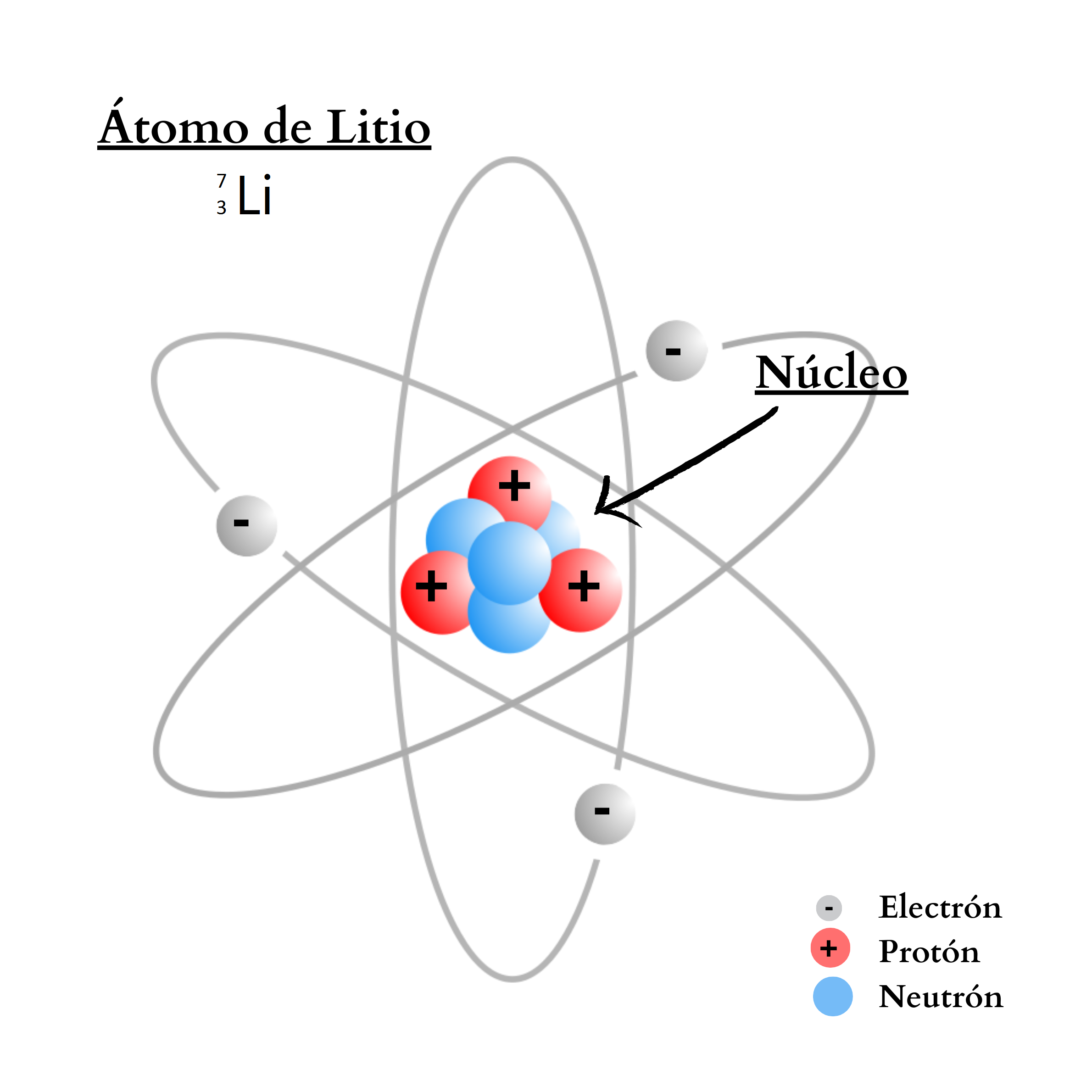
ÁtomoEl átomo es la mínima unidad de la materia que mantiene las propiedades de un elemento químico Un átomo está compuesto por un núcleo y una periferia. En el núcleo del átomo se encuentran los protones y los neutrones. En la periferia se encuentran los electrones. Cada elemento químico se compone de una sola clase de átomos. Cada elemento químico se representa con un símbolo químico formado por una letra o por dos letras. Por ejemplo, el elemento nitrógeno se representa como N, y el elemento calcio como Ca.
This is a modal window. No se ha podido cargar el vídeo debido a un fallo de red o del servidor o porque el formato es incompatible.
|
A |
|---|
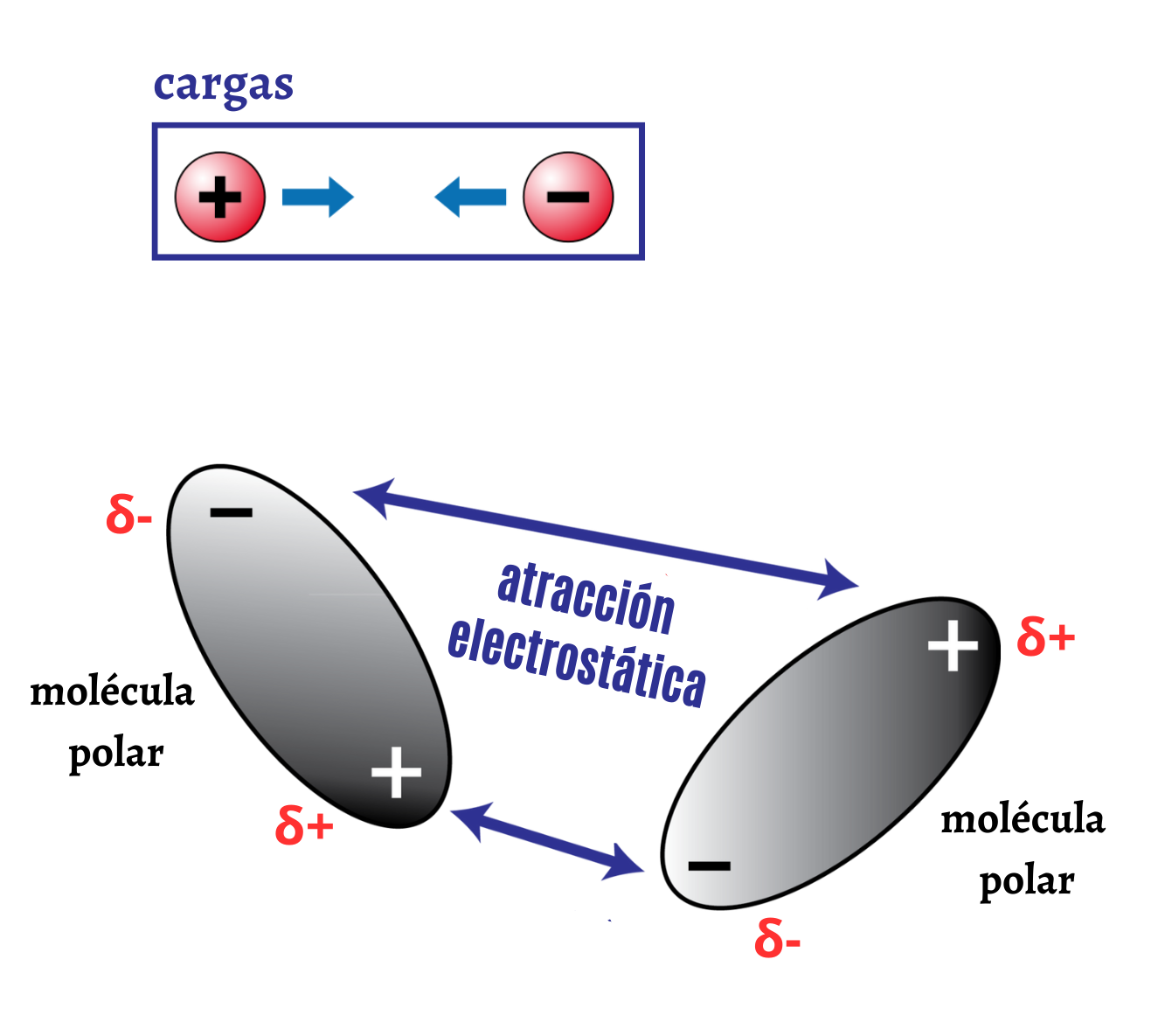
Atracción ElectrostáticaLa atracción electrostática es la interacción entre cargas eléctricas de signo opuesto. La atracción electrostática hace que las cargas de signo opuesto se atraigan. En el caso de moléculas polares la atracción electrostática se establece entre cargas parciales de signo opuesto.
This is a modal window. No se ha podido cargar el vídeo debido a un fallo de red o del servidor o porque el formato es incompatible. |
B |
|---|
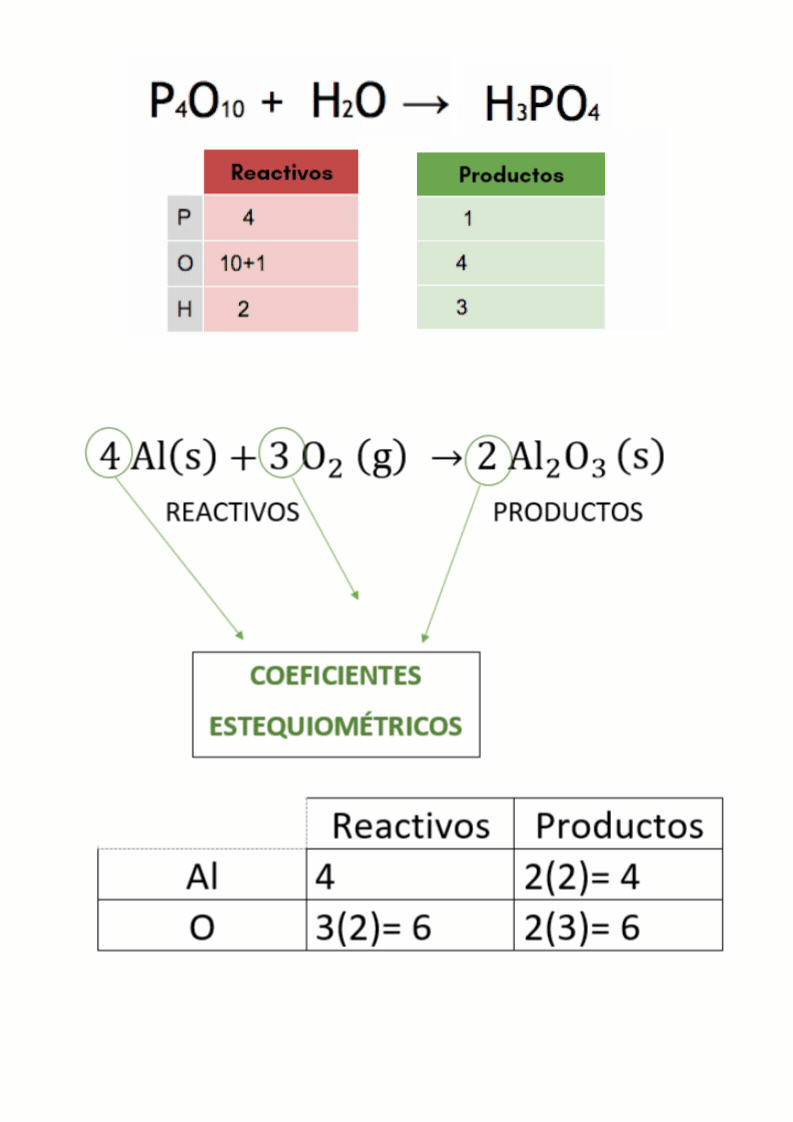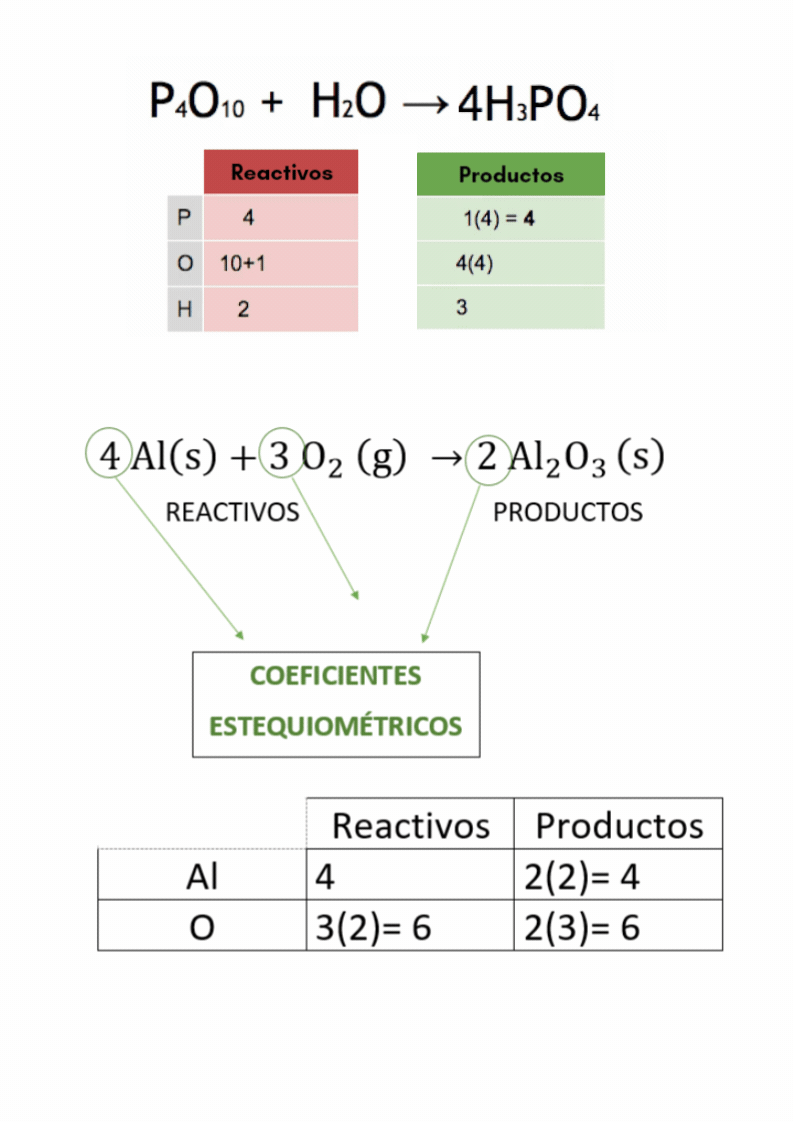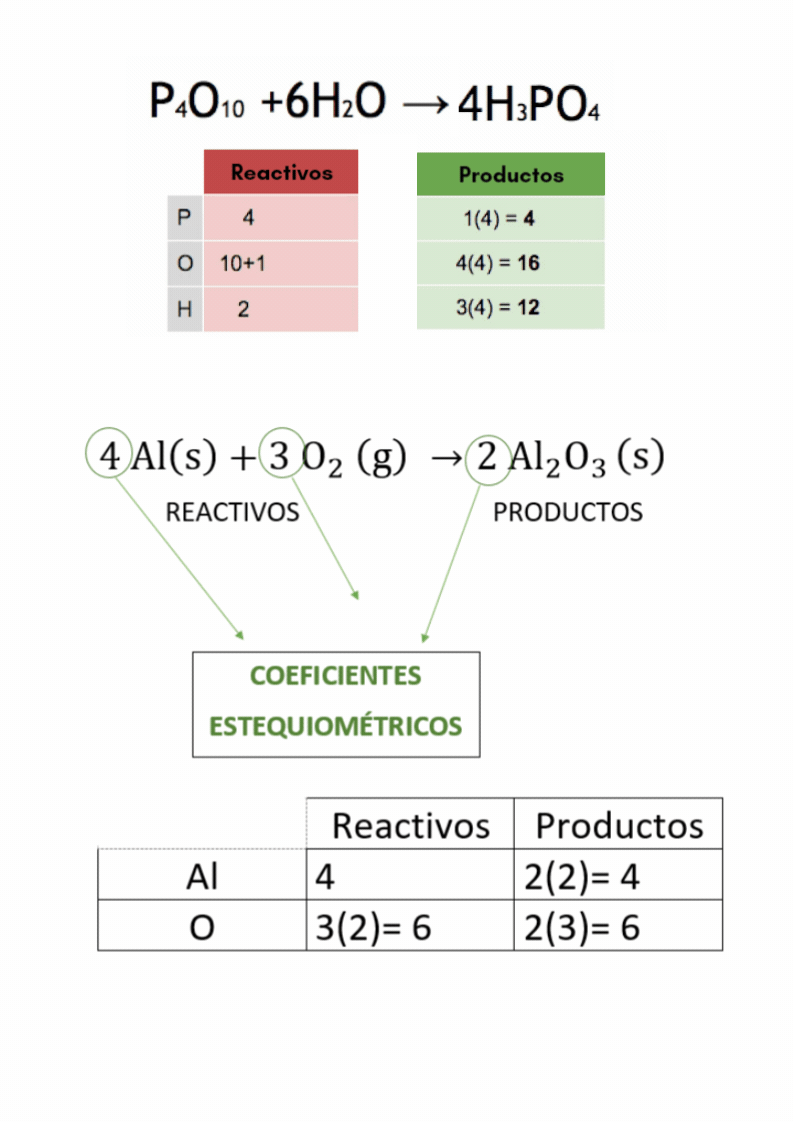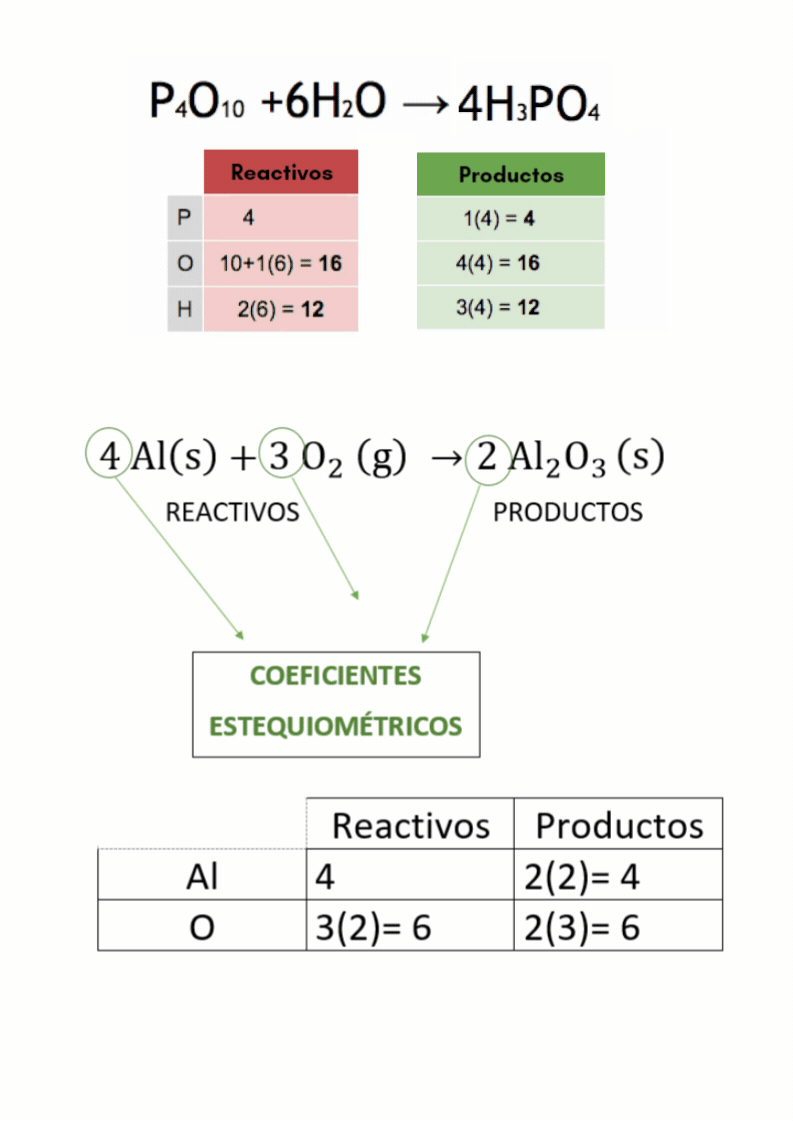
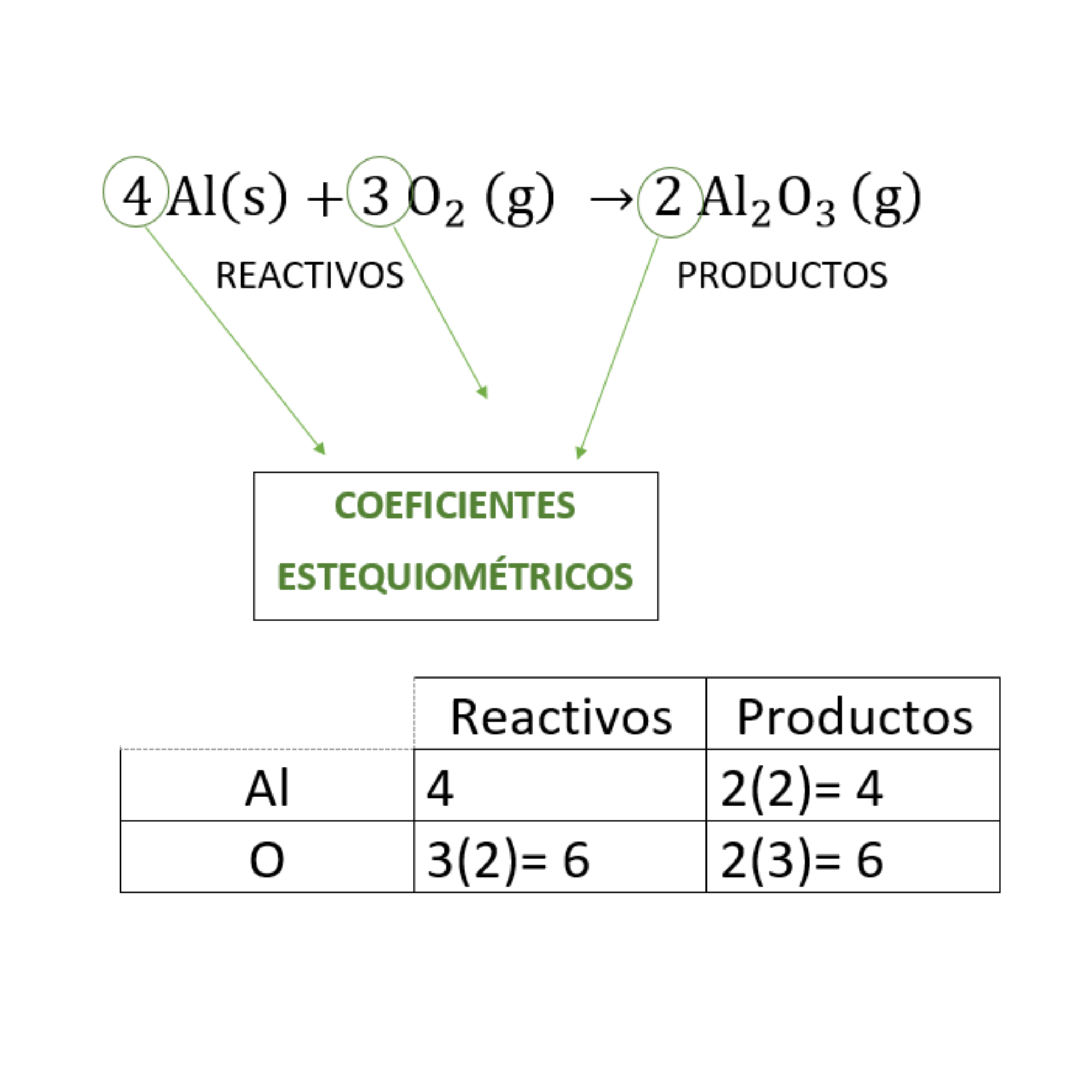
Balanceo o igualación de ecuaciones químicasBalancear
o igualar es hacer que la cantidad de átomos
de
cada elemento
en
los reactivos
sea
igual a la cantidad de átomos
de
cada elemento en los productos El balanceo o igualación de ecuaciones químicas se realiza colocando los coeficientes estequiométricos adecuados en la ecuación química.
This is a modal window. No se ha podido cargar el vídeo debido a un fallo de red o del servidor o porque el formato es incompatible. |
Base (teoría de Brönsted-Lowry)Una base es una sustancia que puede aceptar protones de un ácido. Por ejemplo:
Existen otras teorías de ácidos y bases como por ejemplo la teoría de Lewis. Cuando se disuelve una base en agua el valor de pH de la solución es mayor que 7. Las bases se llaman también álcalis.
This is a modal window. No se ha podido cargar el vídeo debido a un fallo de red o del servidor o porque el formato es incompatible. |
Basicidad o AlcalinidadLa basicidad es la tendencia de una sustancia a aceptar protones de un ácido. La basicidad o alcalinidad es una medida de la fuerza de una base. Cuanto mayor es la basicidad o alcalinidad más fuerte es la base.
This is a modal window. No se ha podido cargar el vídeo debido a un fallo de red o del servidor o porque el formato es incompatible. |
C |
|---|
Cambio FísicoUn
cambio físico es una transformación en la que no se modifica la
composición
química
de
las sustancias. Un ejemplo de cambio físico es la transformación de hielo en agua líquida. En los dos casos la sustancia es agua (H2O).
This is a modal window. No se ha podido cargar el vídeo debido a un fallo de red o del servidor o porque el formato es incompatible. |
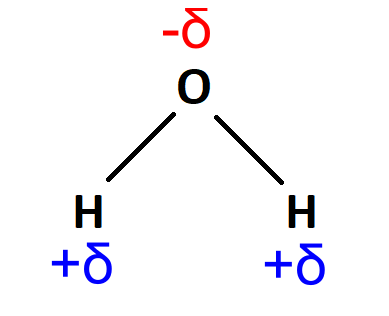
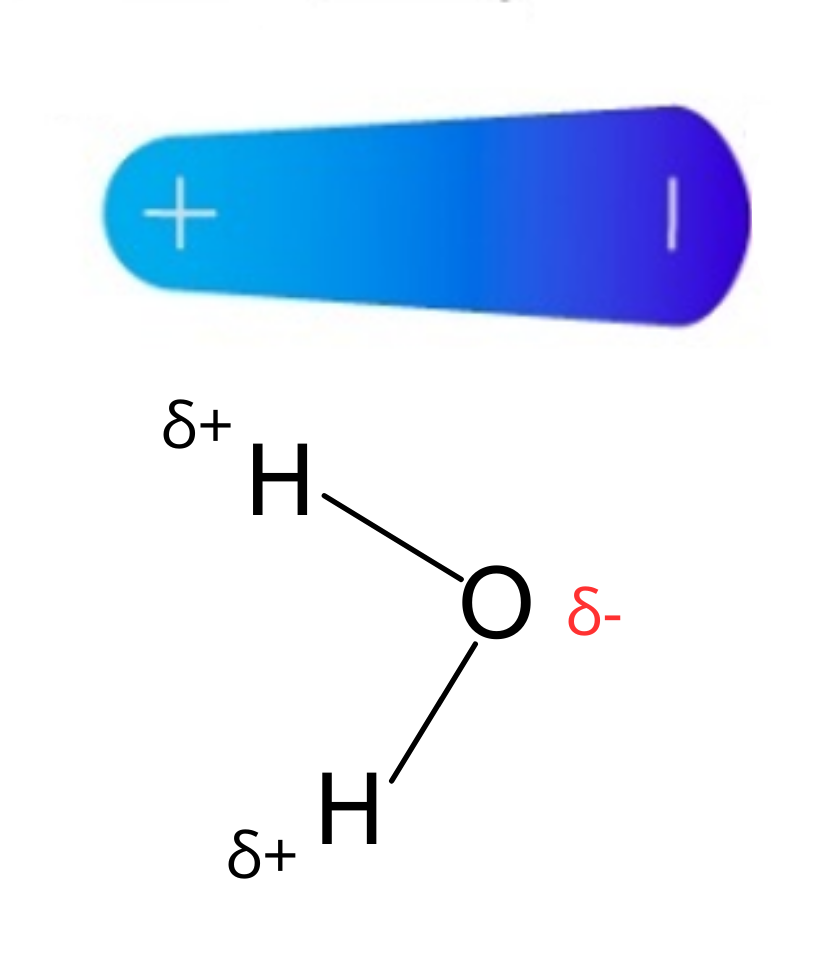
Carga parcialUna carga parcial es una carga eléctrica sobre un átomo. La carga parcial tiene un valor menor a la unidad de carga (1). Las cargas parciales aparecen entre átomos de elementos que tienen diferentes electronegatividades. Las cargas parciales se representan con la letra griega delta (δ) con un signo que indica la carga negativa o positiva: δ− o δ+
This is a modal window. No se ha podido cargar el vídeo debido a un fallo de red o del servidor o porque el formato es incompatible. |
CatiónUn
catión es un ion
con
carga eléctrica positiva. Ejemplos:
This is a modal window. No se ha podido cargar el vídeo debido a un fallo de red o del servidor o porque el formato es incompatible. |
Coeficientes estequiométricosLos
coeficientes estequiométricos indican las cantidades de las
sustancias
químicas
que participan en una reacción química. Los coeficientes estequiométricos son los números escritos adelante de cada fórmula química en las ecuaciones químicas. El balanceo o igualación de ecuaciones químicas se realiza colocando los coeficientes estequiométricos adecuados en la ecuación química.
This is a modal window. No se ha podido cargar el vídeo debido a un fallo de red o del servidor o porque el formato es incompatible. |
Composición QuímicaLa
composición química de una sustancia
es
el tipo y cantidad de cada elemento
dentro
de la sustancia. Por ejemplo, la sustancia agua está compuesta por los elementos hidrógeno y oxígeno. En cada molécula de agua, por cada átomo de oxígeno (O) hay 2 átomos de hidrógeno (H). Si se modifica la composición química de una sustancia se transforma en una nueva sustancia.
This is a modal window. No se ha podido cargar el vídeo debido a un fallo de red o del servidor o porque el formato es incompatible. |
CompuestoUn
compuesto es una sustancia
formada
por dos o más elementos. Un ejemplo de compuesto es el agua (H2O), que está compuesta por los elementos químicos hidrógeno y oxígeno.
This is a modal window. No se ha podido cargar el vídeo debido a un fallo de red o del servidor o porque el formato es incompatible. |
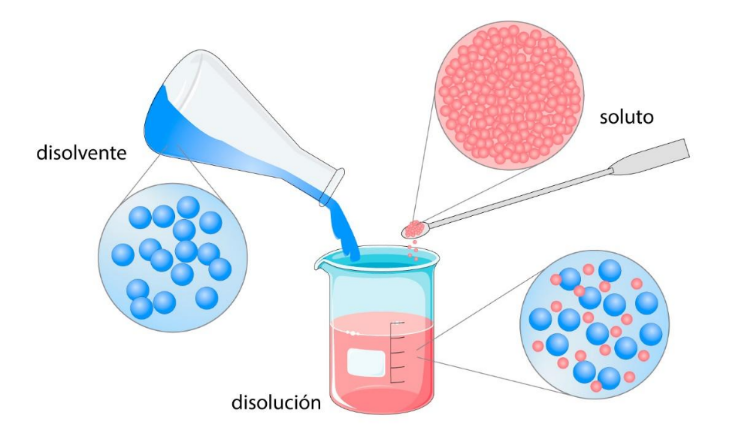
ConcentraciónLa concentración de un soluto es la cantidad de este soluto disuelta en una cantidad conocida de disolución o en una cantidad conocida de disolvente. Algunas formas de expresar la concentración son:
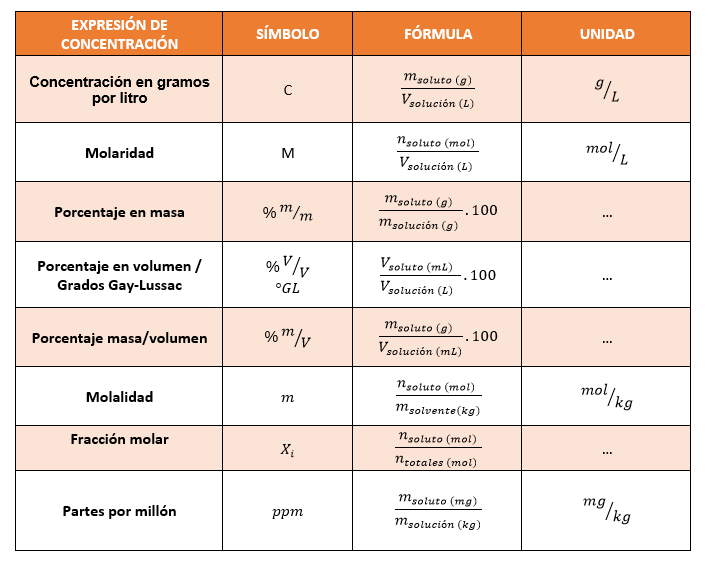
This is a modal window. No se ha podido cargar el vídeo debido a un fallo de red o del servidor o porque el formato es incompatible. |
D |
|---|
DipoloUn dipolo es un sistema formado por dos cargas opuestas (una de las cargas es positiva y la otra carga es negativa). Las cargas se encuentran cercanas. En una molécula se forma un dipolo cuando una región de la molécula tiene carga parcial positiva y otra región de la molécula tiene carga parcial negativa.
This is a modal window. No se ha podido cargar el vídeo debido a un fallo de red o del servidor o porque el formato es incompatible. |
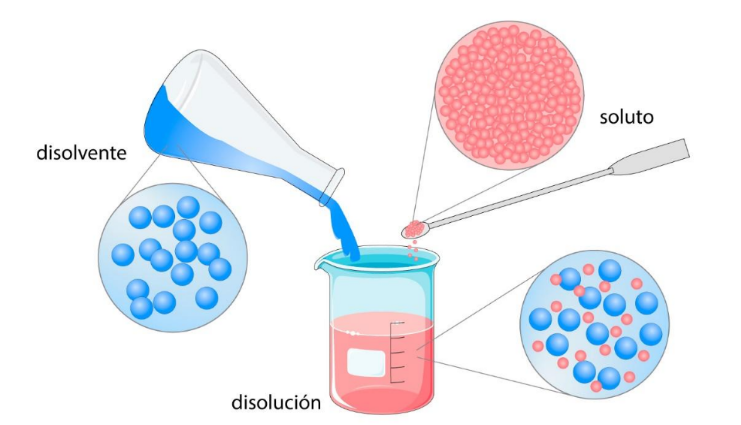
Disolución o Solución |
Disolvente o Solvente |
E |
|---|
Ecuación QuímicaLa ecuación química es la representación de una reacción química. En
las ecuaciones químicas se usan las fórmulas
químicas
de
los
reactivos
y
productos. Las ecuaciones químicas están balanceadas cuando la cantidad de átomos de cada elemento en los reactivos es igual a la cantidad de átomos de cada elemento en los productos. Es frecuente que en las ecuaciones químicas se muestre el estado de agregación de cada sustancia.
This is a modal window. No se ha podido cargar el vídeo debido a un fallo de red o del servidor o porque el formato es incompatible. |
ElectrónUn electrón es una partícula de carga negativa. El electrón se
encuentra en la periferia
del
átomo. Los
electrones
de valencia
son
los electrones que participan en el
enlace
químico.
This is a modal window. No se ha podido cargar el vídeo debido a un fallo de red o del servidor o porque el formato es incompatible. |
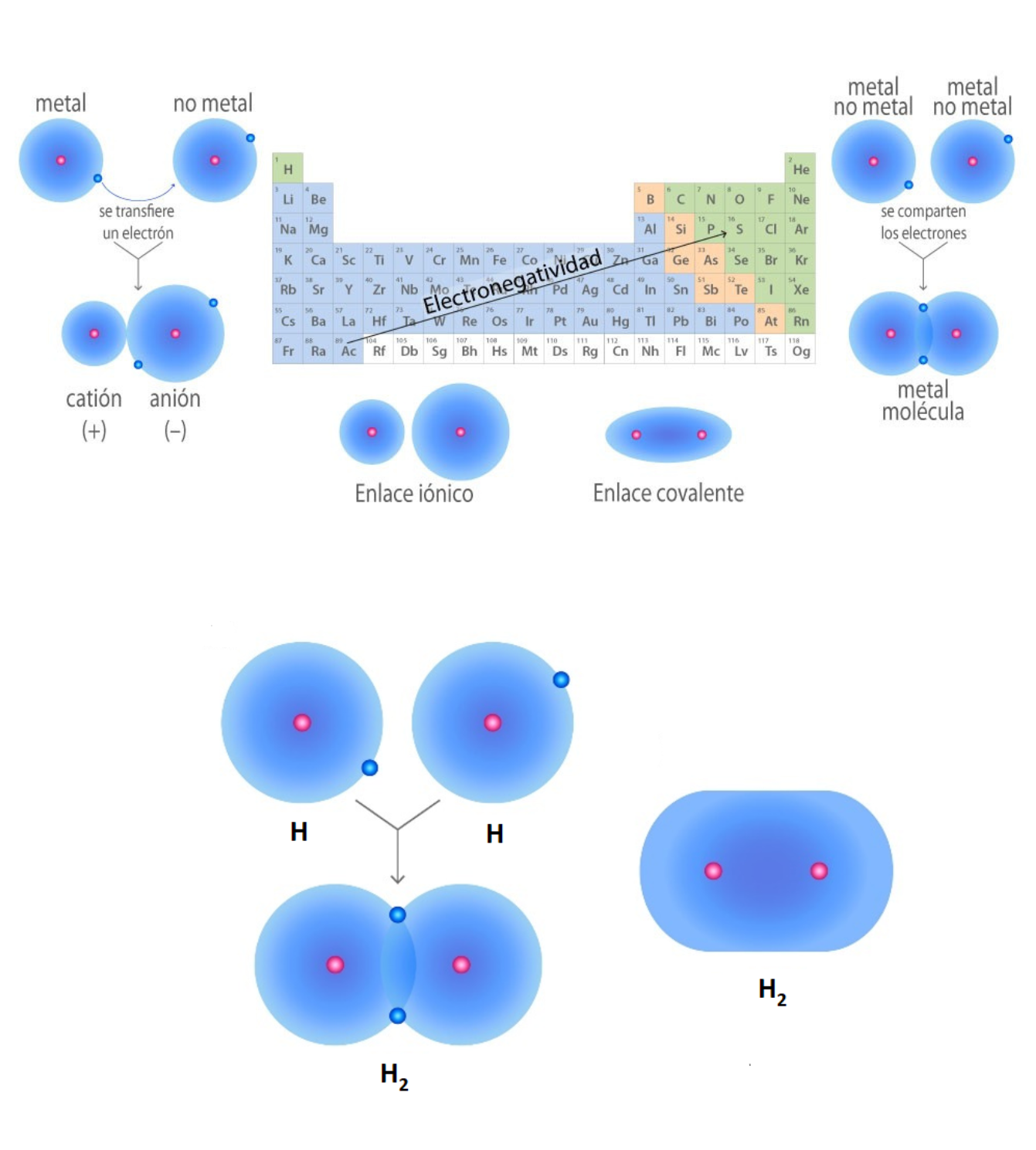
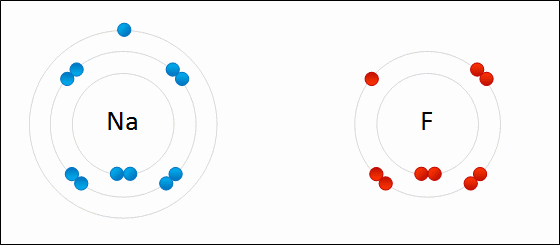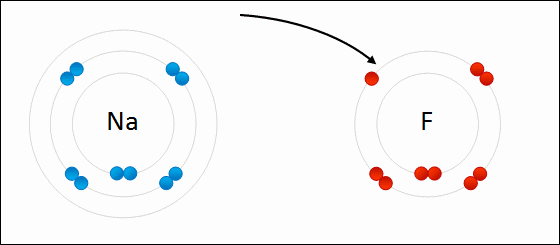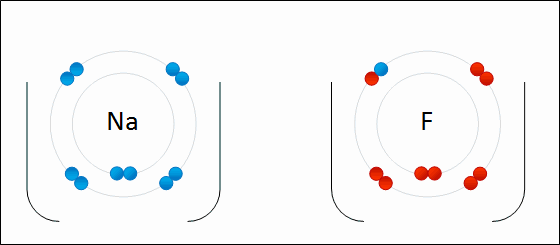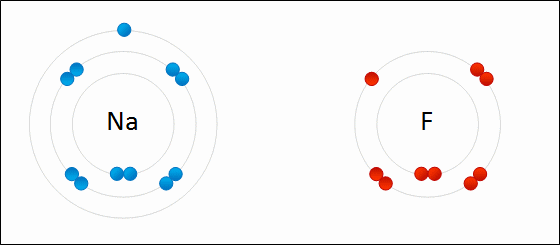
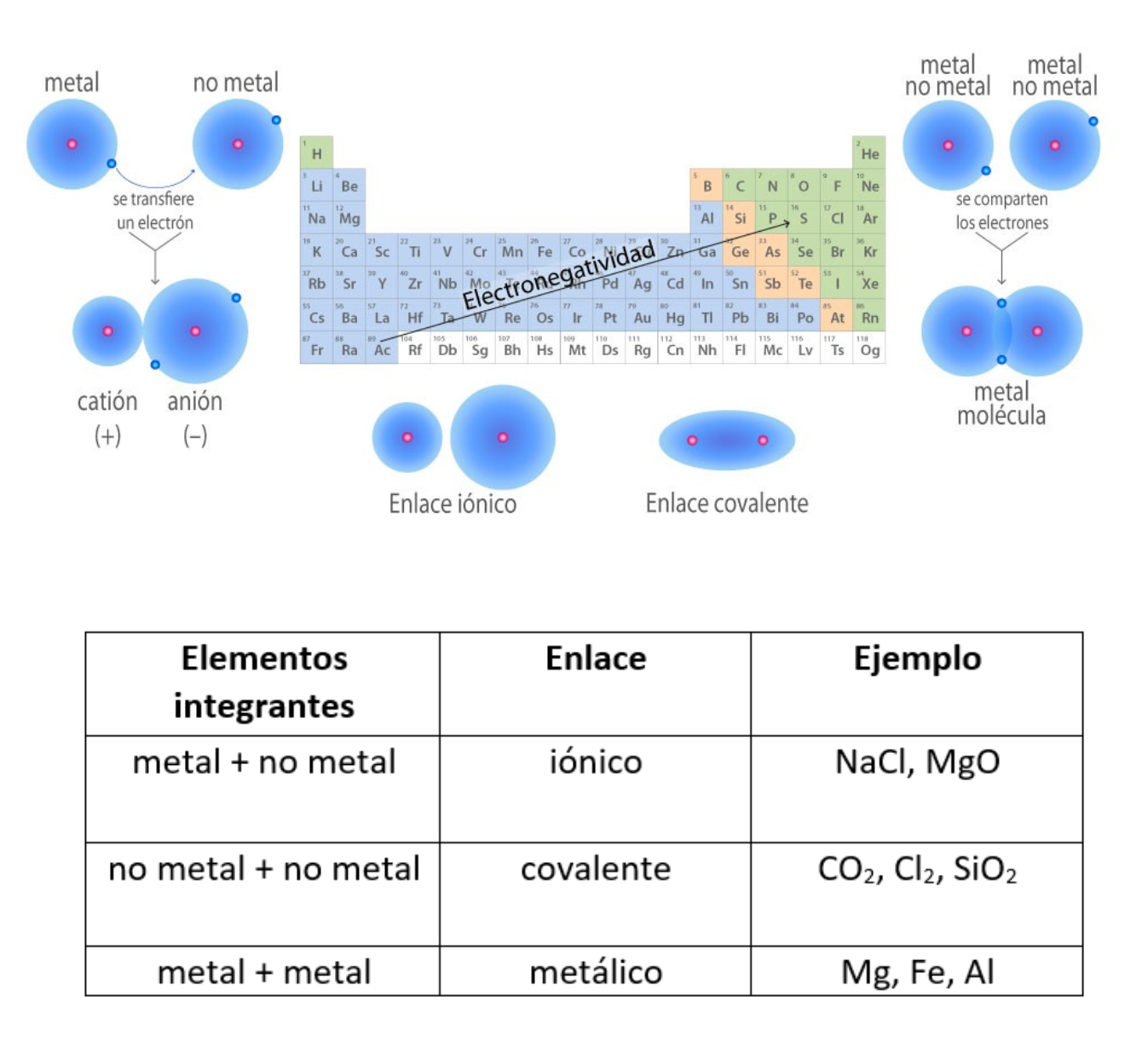
ElectronegatividadLa electronegatividad es la capacidad de un átomo que está unido a otro átomo de atraer electrones del enlace. Cuanto mayor sea la electronegatividad, la capacidad de atraer los electrones del enlace será mayor. La diferencia entre las electronegatividades de los átomos en un enlace determina el tipo de enlace químico.
This is a modal window. No se ha podido cargar el vídeo debido a un fallo de red o del servidor o porque el formato es incompatible.
|
Elemento Químico
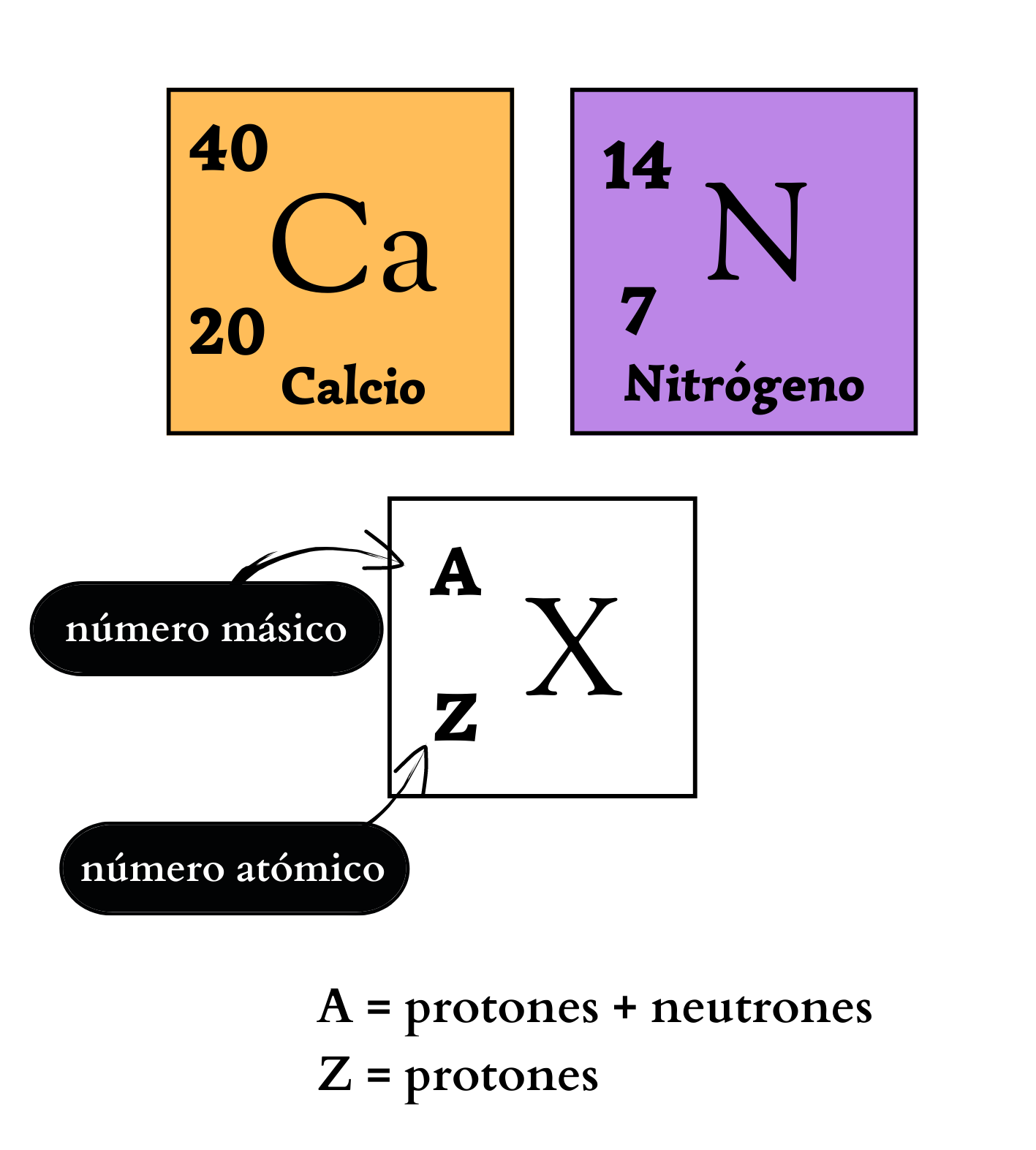
El elemento químico es una sustancia que no se puede descomponer en otra sustancia más simple. Cada elemento químico se representa con un símbolo químico formado por una letra o por dos letras. Por ejemplo, el elemento nitrógeno se representa como N, y el elemento calcio como Ca. Todos los elementos conocidos se ordenan en la Tabla Periódica. Todos los átomos de un mismo elemento tienen la misma cantidad de protones.
Elemento químico Representación de un elemento en la tabla periódica. De forma genérica, con la letra equis mayúscula hay un símbolo químico de un elemento. Arriba a la izquierda, como superíndice, la letra a mayúscula representa el número másico, que indica la cantidad de protones más la cantidad de neutrones. Abajo a la izquierda, como subíndice, la letra mayúscula zeta representa la cantidad de protones. Ejemplos Como ejemplos se indican: El elemento calcio, C mayúscula, a minúscula, número másico 40, y número atómico 20. Y el elemento nitrógeno, ene mayúscula, número másico 14, y número atómico 7. |
Enlace CovalenteEl
enlace covalente es un enlace
químico
formado
entre dos átomos
que
comparten electrones. La diferencia de electronegatividad entre los átomos que se enlazan puede ser de nula a intermedia. Se llama enlace covalente no polar cuando los electrones del enlace se comparten por igual entre los átomos. En este caso la diferencia de electronegatividad es nula. Se llama enlace covalente polar cuando los electrones del enlace no se comparten por igual entre los átomos. En este caso la diferencia de electronegatividad es intermedia.
This is a modal window. No se ha podido cargar el vídeo debido a un fallo de red o del servidor o porque el formato es incompatible. |
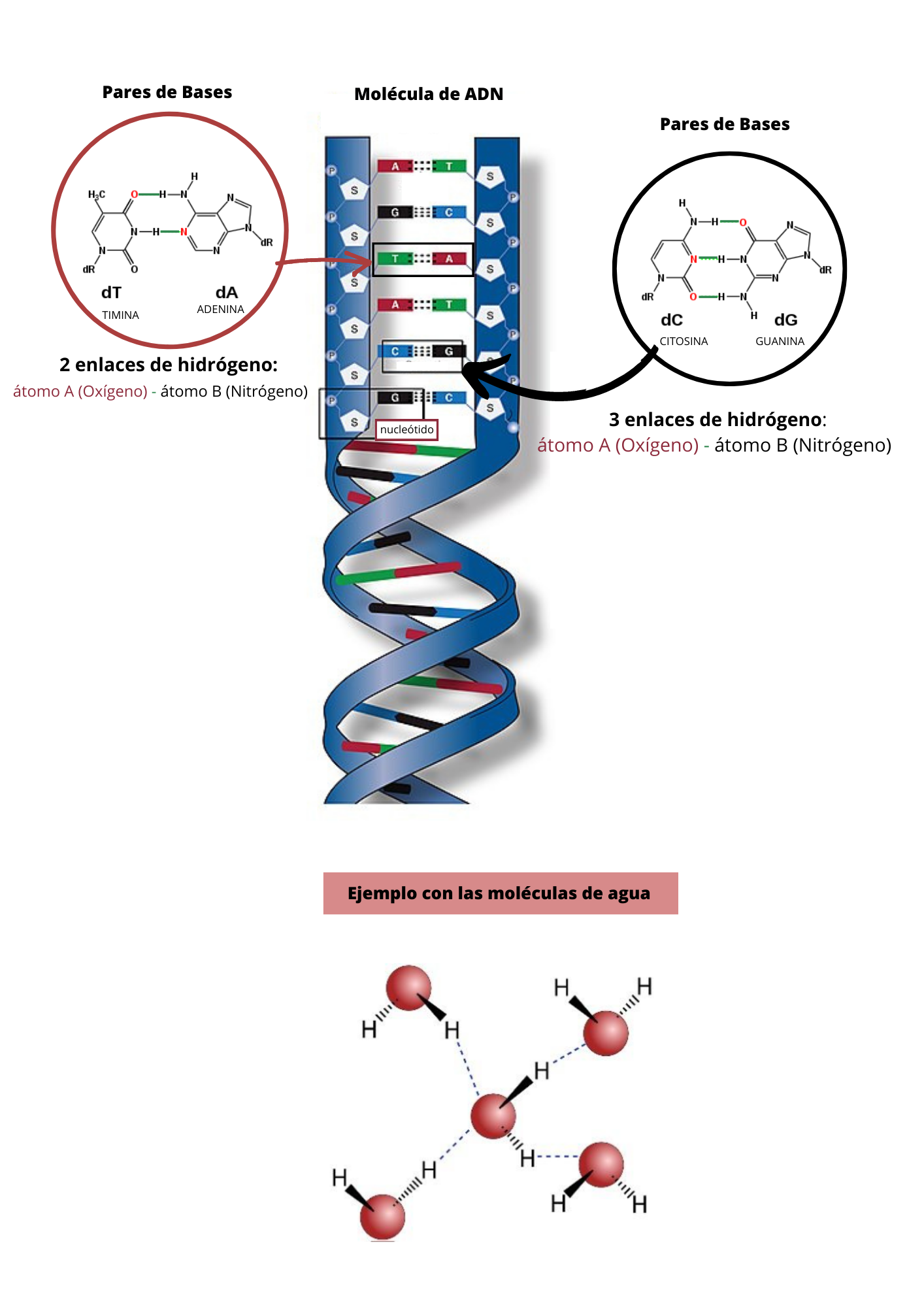
Enlace de hidrógenoEl enlace de hidrógeno es un tipo de enlace de baja energía. El enlace de hidrógeno se establece entre un átomo de hidrógeno y un átomo electronegativo A. Para que se forme el enlace de hidrógeno, el átomo de hidrógeno debe estar unido por enlace covalente a un átomo electronegativo B. El Enlace de Hidrógeno antes se llamaba Puente de Hidrógeno. Por lo general A y B, son oxígeno (O), nitrógeno (N), flúor (F) o cloro (Cl).
This is a modal window. No se ha podido cargar el vídeo debido a un fallo de red o del servidor o porque el formato es incompatible. |
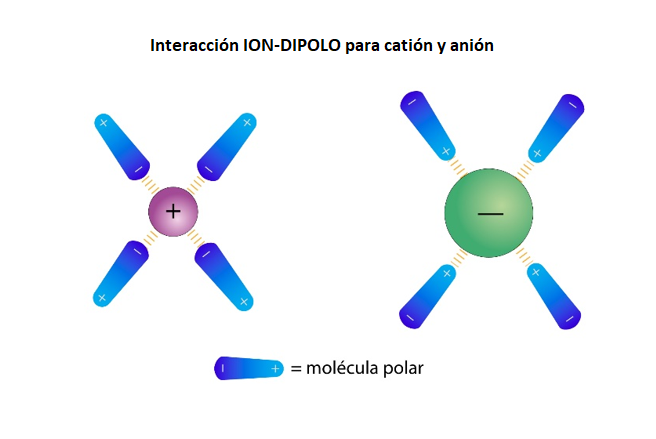
Enlace Ion-DipoloEl
enlace ion-dipolo es un tipo de enlace
de baja energía. El enlace ion-dipolo se establece entre un ion y moléculas polares. El enlace ion-dipolo se establece, por ejemplo, entre los iones que están disueltos en agua y las moléculas de agua.
This is a modal window. No se ha podido cargar el vídeo debido a un fallo de red o del servidor o porque el formato es incompatible. |
Enlace IónicoEl
enlace iónico es el enlace que mantiene unido a los cationes y
aniones en las sustancias
iónicas. Un enlace iónico es la atracción electrostática entre las cargas eléctricas de cationes y aniones. Los cationes y aniones se forman a partir de átomos con una diferencia de electronegatividad muy grande.
This is a modal window. No se ha podido cargar el vídeo debido a un fallo de red o del servidor o porque el formato es incompatible. |
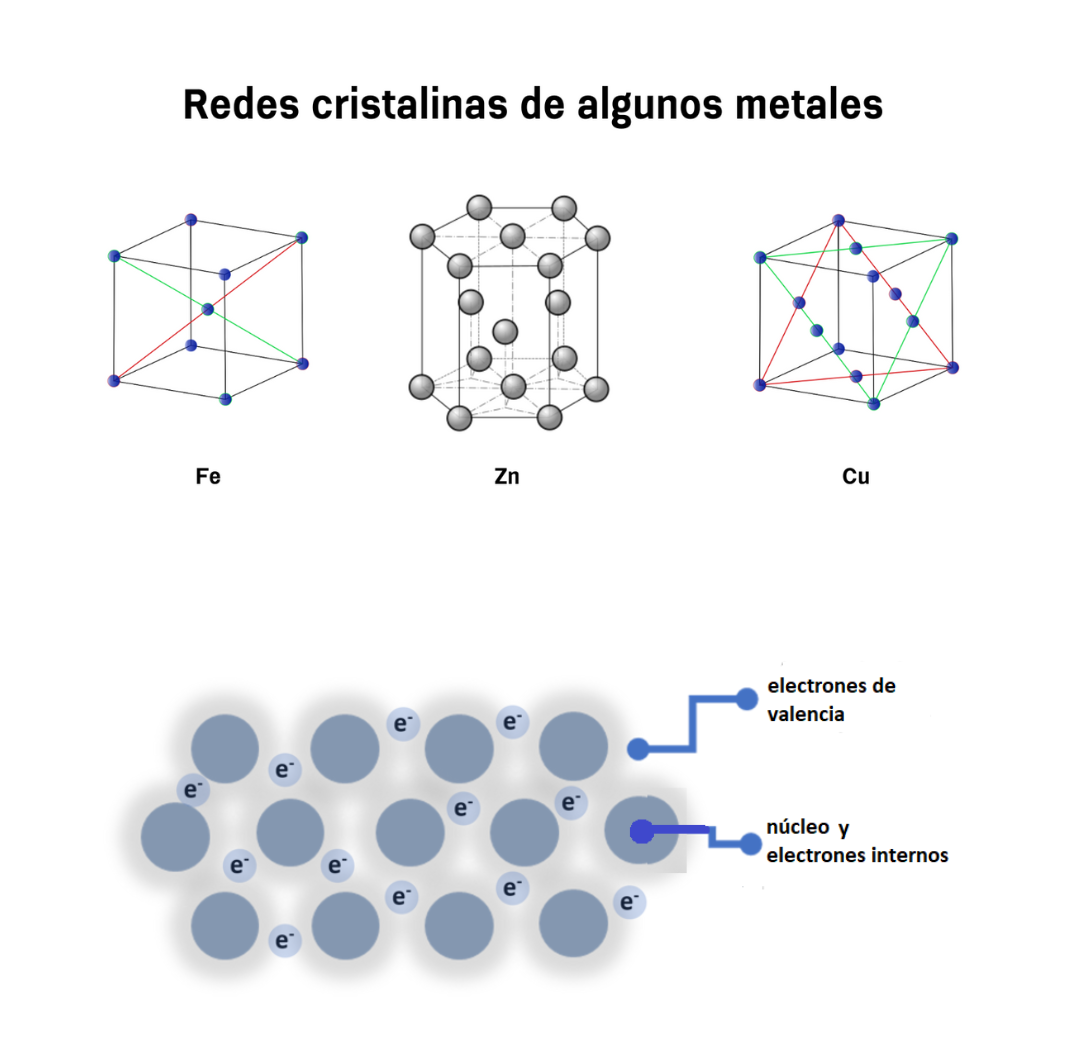
Enlace MetálicoEl enlace metálico es un enlace químico que mantiene unidos a los átomos de los metales. En el enlace metálico los núcleos y los electrones internos de los átomos se encuentran ordenados en una red cristalina. Los electrones de valencia de esos átomos se mueven de forma libre a lo largo de todo el metal. Los electrones de valencia se comparten entre todos los átomos del metal. Los electrones de valencia del metal están deslocalizados. El enlace metálico genera características en los metales. Los metales:
This is a modal window. No se ha podido cargar el vídeo debido a un fallo de red o del servidor o porque el formato es incompatible. |
Enlace Químico (Unión Química)El
enlace químico es la fuerza que une átomos,
moléculas
o
iones
entre
sí. Los enlaces químicos generan grupos de átomos, moléculas o iones unidos entre sí de forma estable. Por ejemplo, el enlace que existe entre 2 átomos de hidrógeno (H) forma la molécula de dihidrógeno (H2). Tipos de enlaces:
This is a modal window. No se ha podido cargar el vídeo debido a un fallo de red o del servidor o porque el formato es incompatible. |
Enlaces de Baja EnergíaSon
enlaces
químicos
que
poseen baja energía
de enlace
y
actúan a distancias muy cortas. Los enlaces de baja energía tienen menor energía que los enlaces:
Existen diferentes tipos de enlaces de baja energía:
This is a modal window. No se ha podido cargar el vídeo debido a un fallo de red o del servidor o porque el formato es incompatible. |
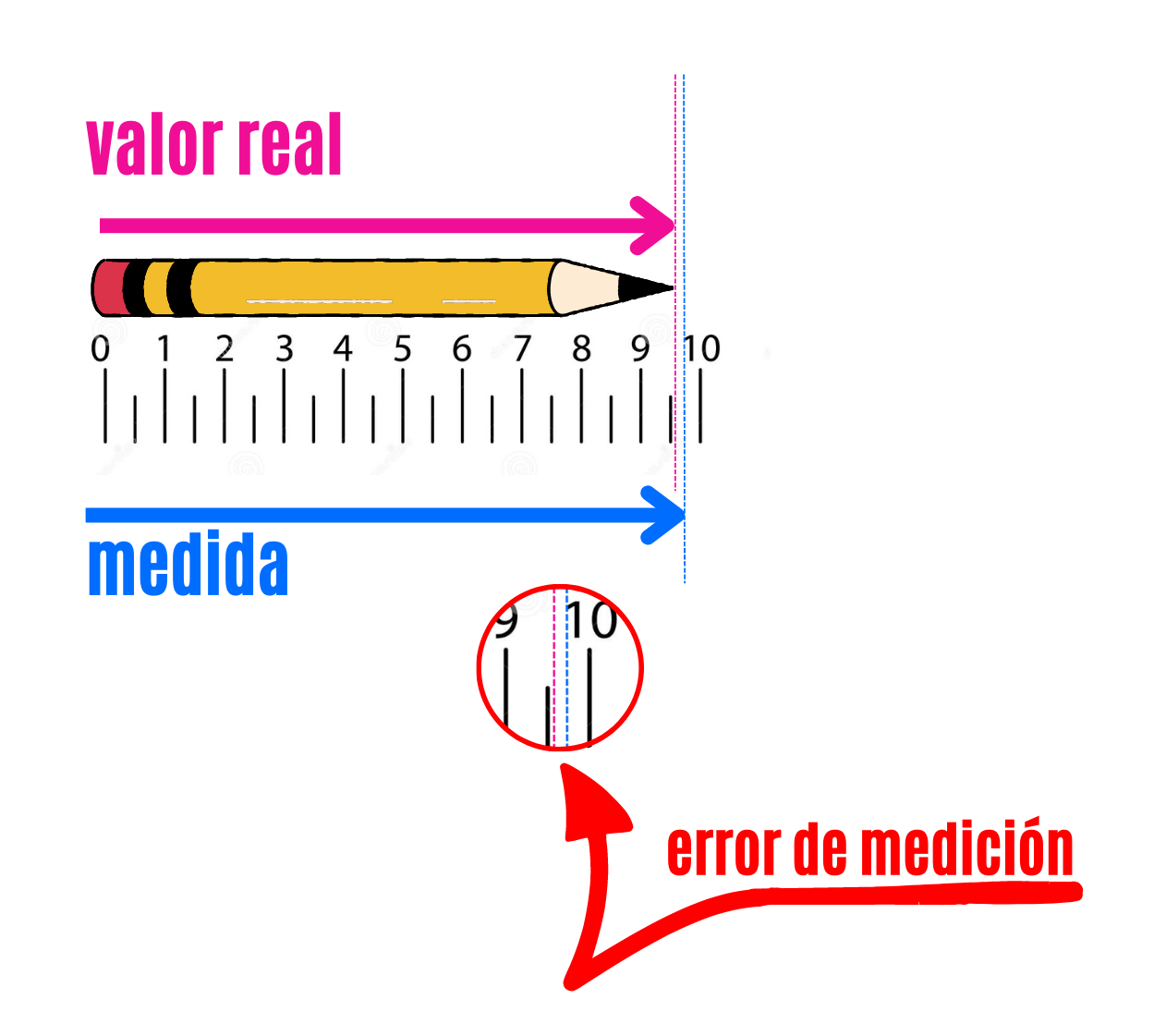
Error de Medición |
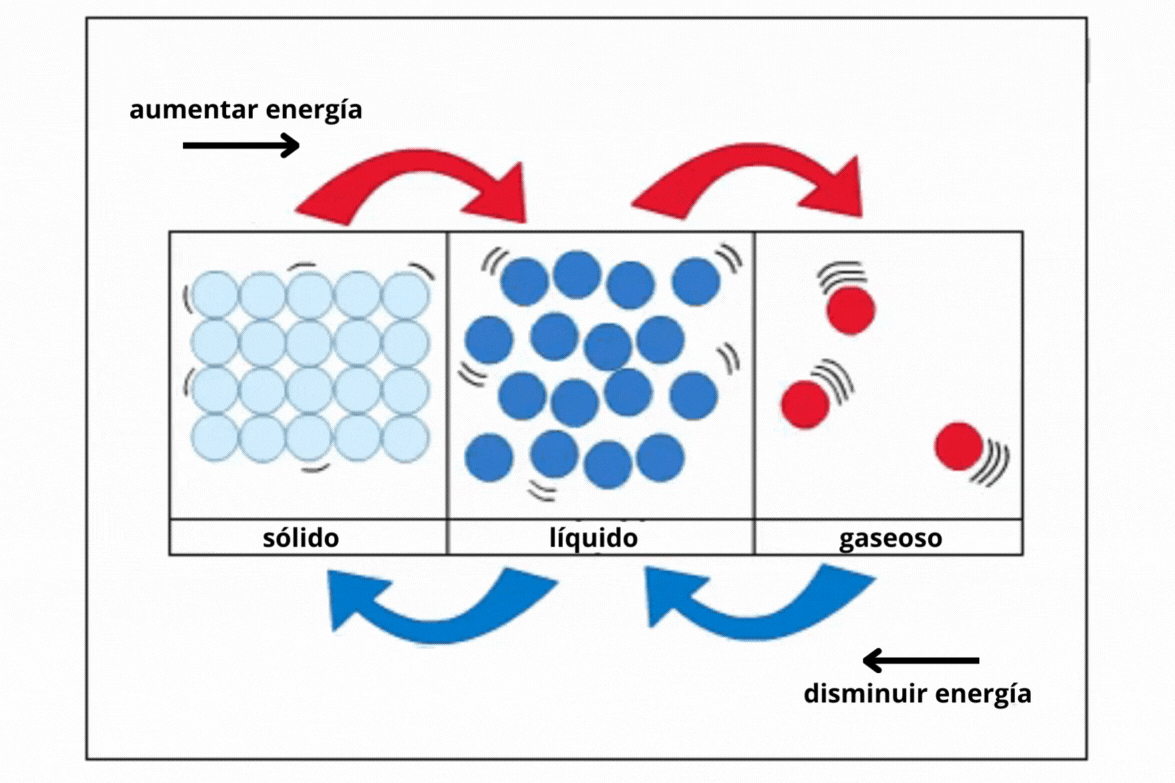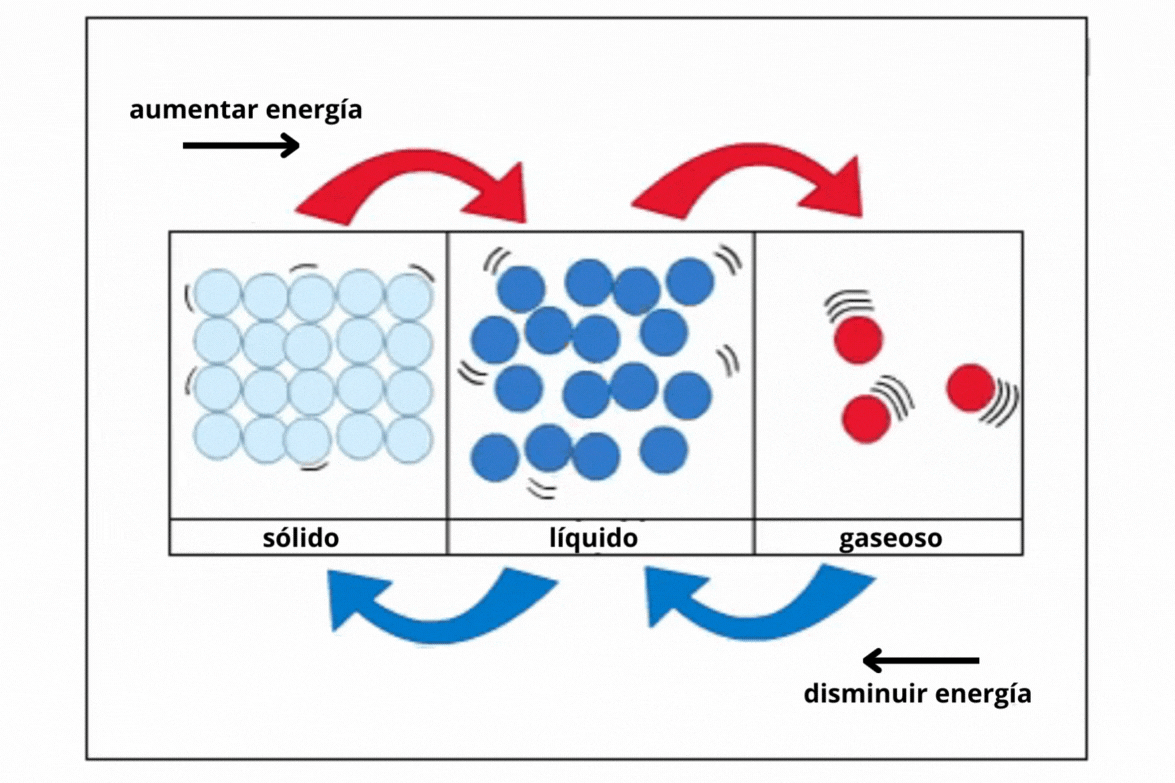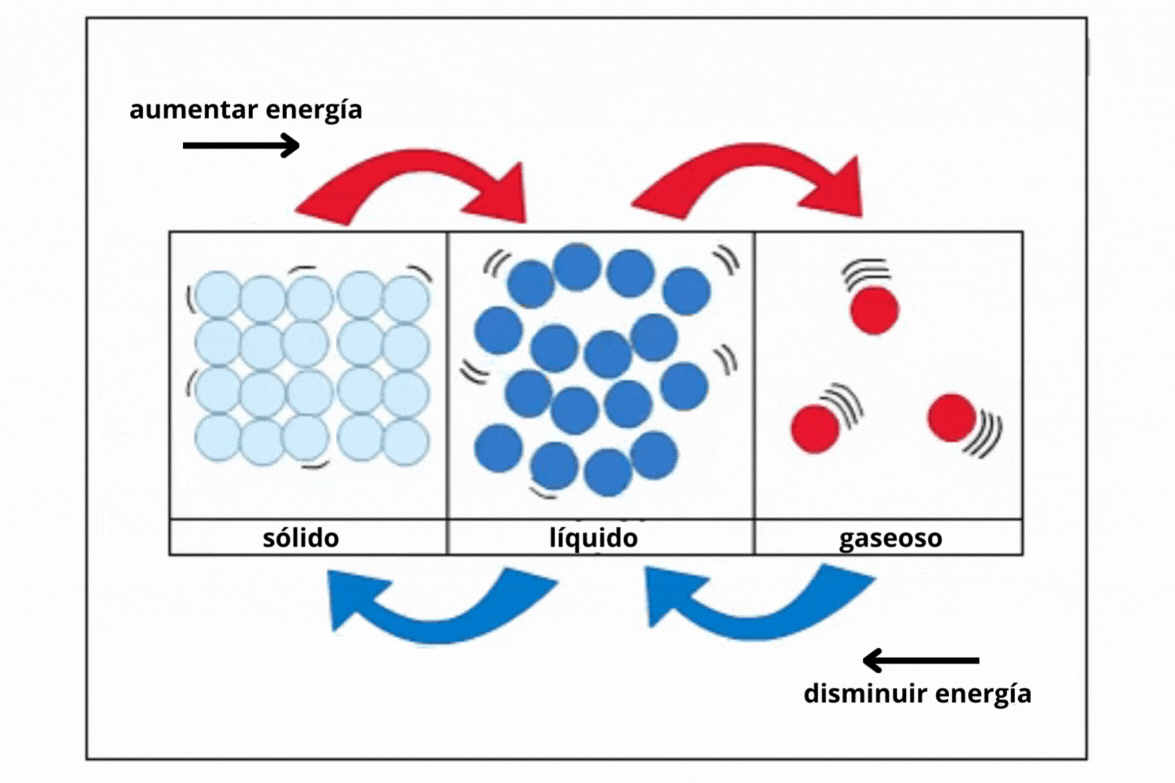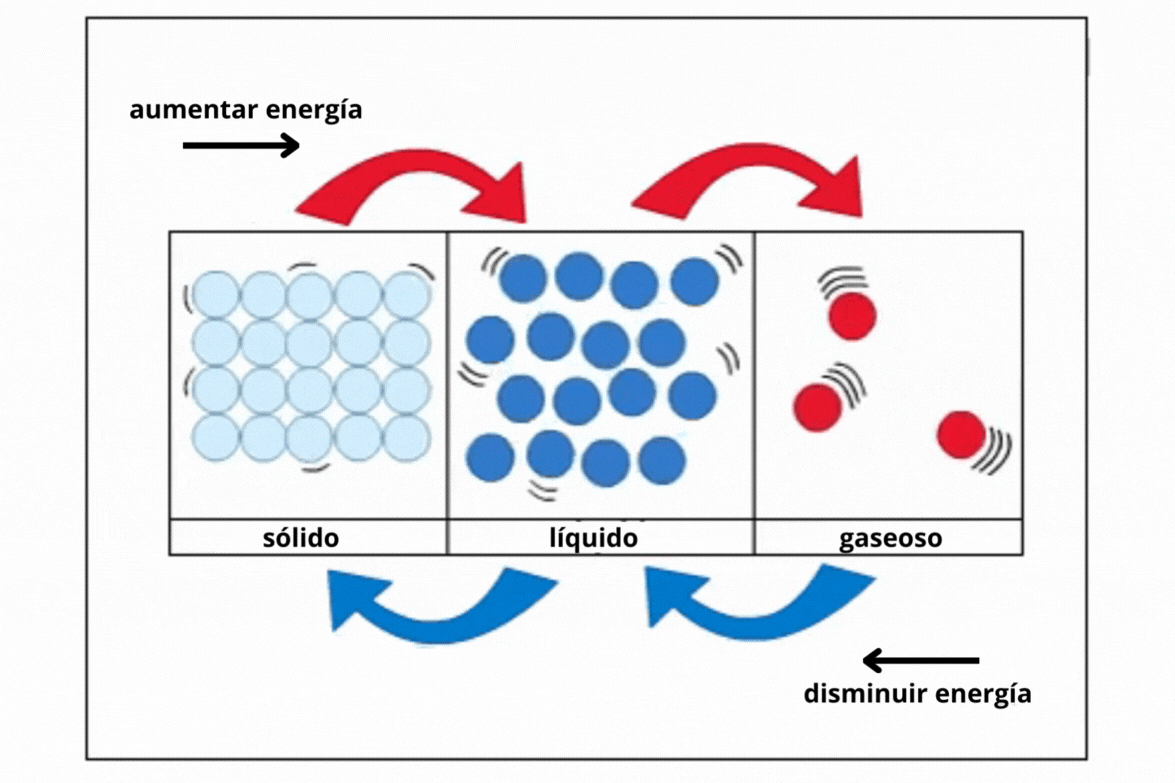
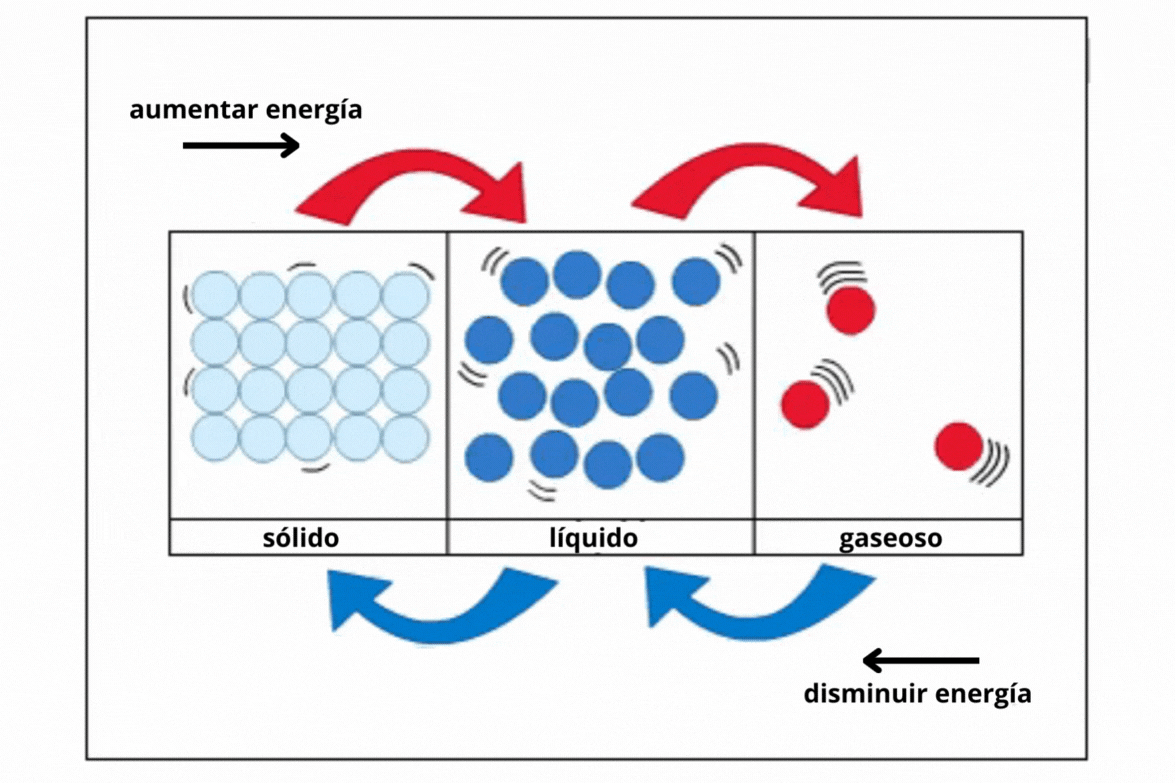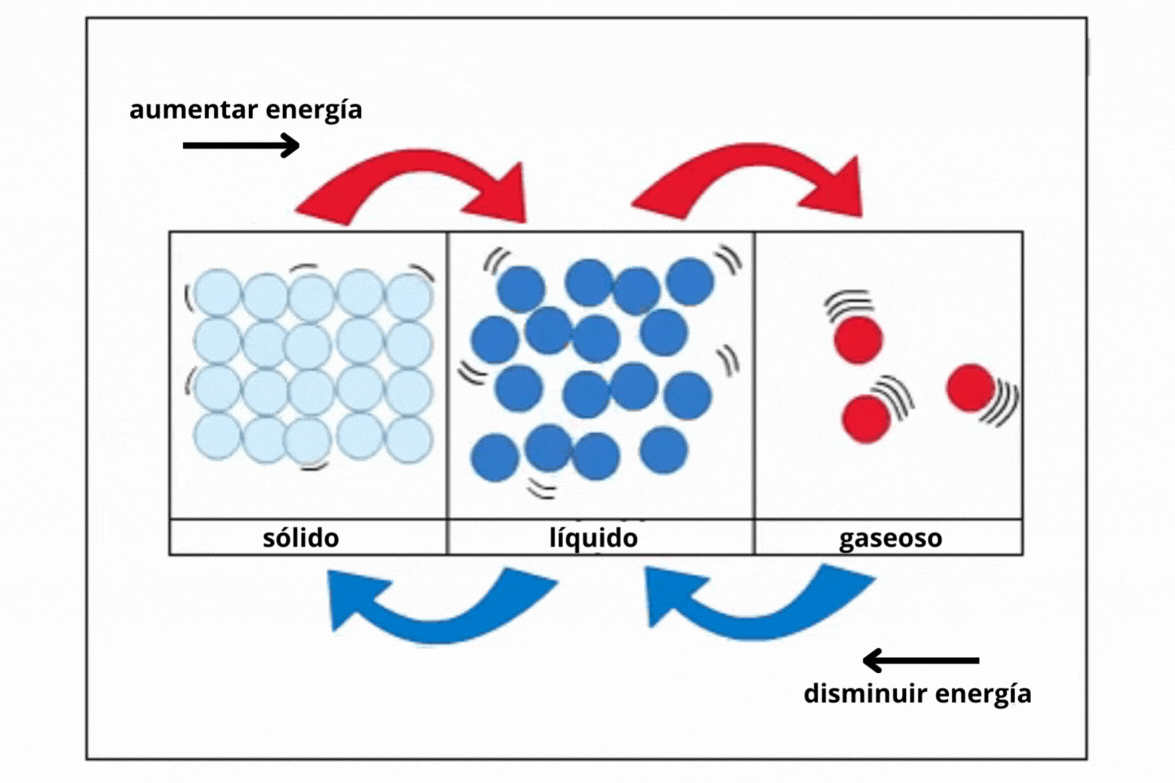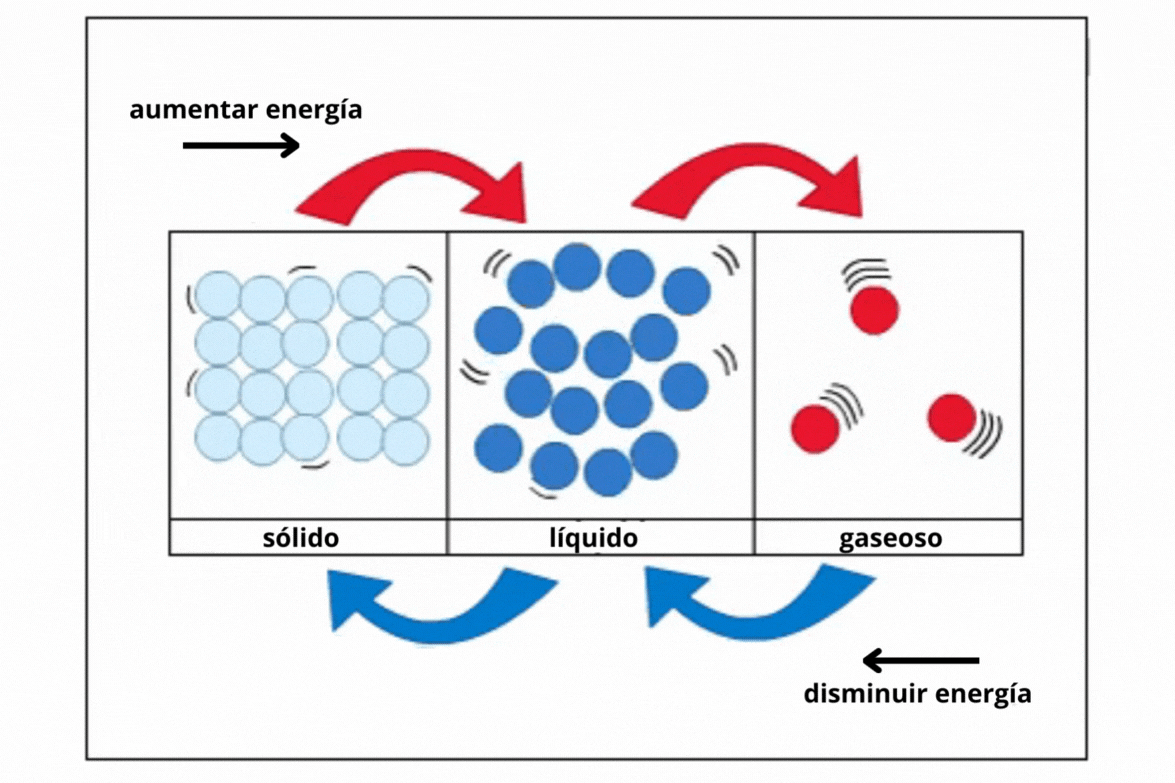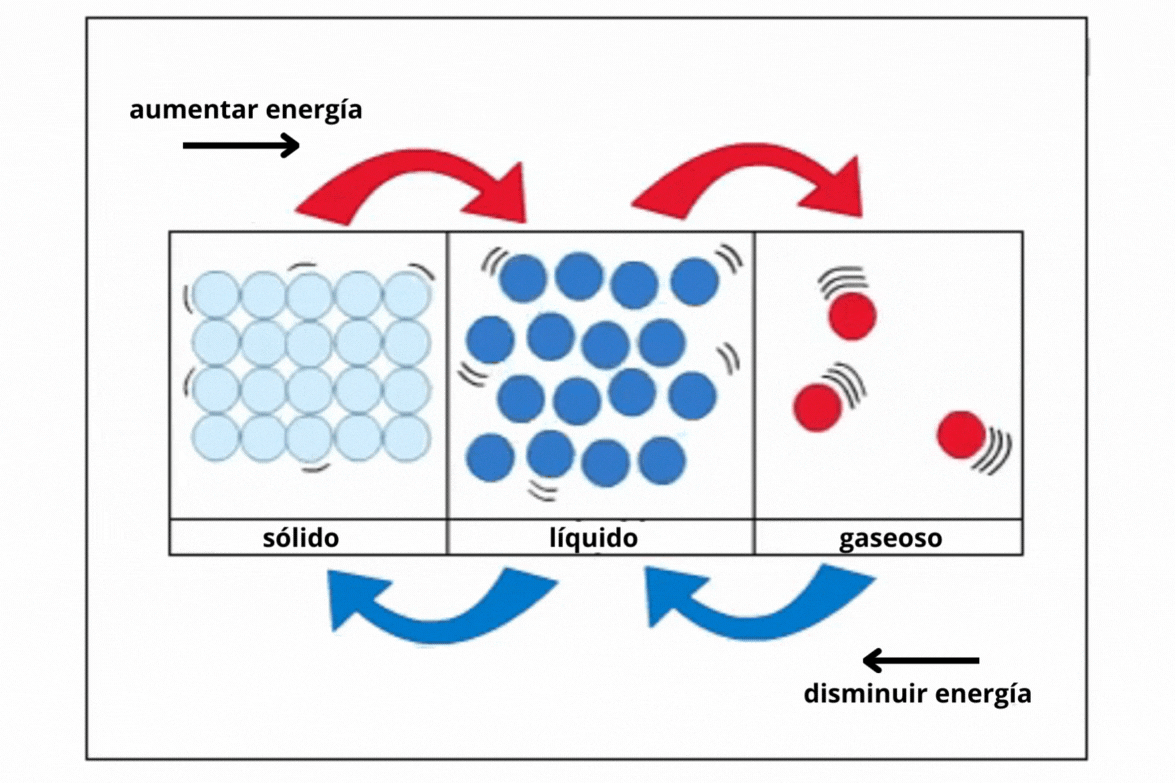
Estado de agregaciónEl
estado de agregación de una sustancia es la forma en la que la
sustancia se encuentra a una temperatura y presión determinadas. Los estados de agregación más comunes en la naturaleza son sólido (s), líquido (l) y gaseoso (g).
This is a modal window. No se ha podido cargar el vídeo debido a un fallo de red o del servidor o porque el formato es incompatible. |
F |
|---|
FaseUna
fase es una porción de materia
que
mantiene en todos sus puntos las propiedades
intensivas. Una fase puede estar compuesta por más de una sustancia. La composición química de la fase es uniforme. Ejemplo: azúcar disuelta en agua.
This is a modal window. No se ha podido cargar el vídeo debido a un fallo de red o del servidor o porque el formato es incompatible. |
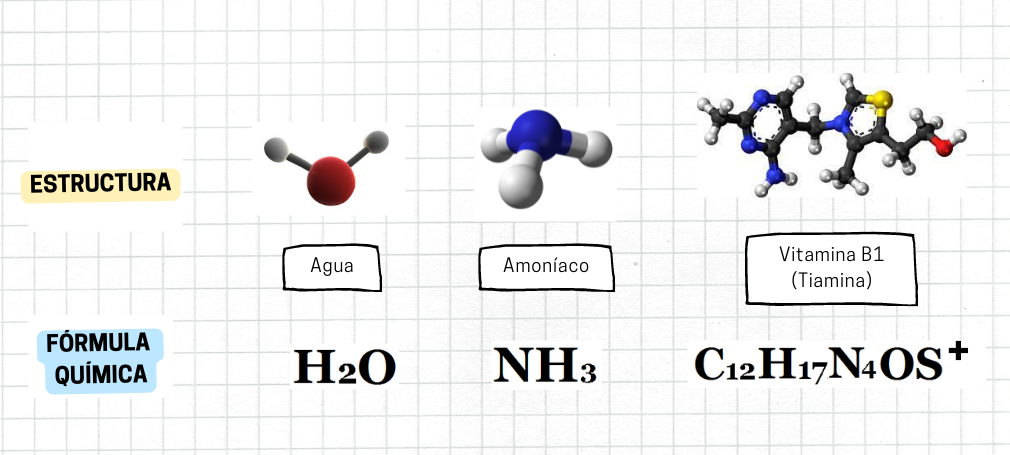
Fórmula QuímicaLa
fórmula química es una forma de representar a una sustancia. La
fórmula química muestra la composición
química
de
la sustancia. La fórmula química utiliza símbolos químicos y subíndices numéricos. Los subíndices numéricos representan las cantidades relativas (proporciones) de los átomos de los diferentes elementos que forman la sustancia Por ejemplo, la fórmula química del agua es H₂O, y muestra que el agua está compuesta por los elementos hidrógeno y oxígeno, en proporción relativa 2 a 1.
This is a modal window. No se ha podido cargar el vídeo debido a un fallo de red o del servidor o porque el formato es incompatible. |
Fracción MolarLa fracción molar es una forma de expresar la concentración de una solución. La fracción molar se define como la cantidad química de un soluto presente en el número total de moles presentes en la solución. La cantidad química debe estar expresada en mol.This is a modal window. No se ha podido cargar el vídeo debido a un fallo de red o del servidor o porque el formato es incompatible. |
Fuerzas De Van der WaalsLas
fuerzas de Van der Waals son un tipo de enlace de baja energía que
se establece entre las moléculas. Las fuerzas de Van der Waals son las fuerzas de atracción o fuerzas de repulsión entre las moléculas. Existen tres tipos de fuerzas de Van der Waals:
This is a modal window. No se ha podido cargar el vídeo debido a un fallo de red o del servidor o porque el formato es incompatible. |
G |
|---|
Gas |
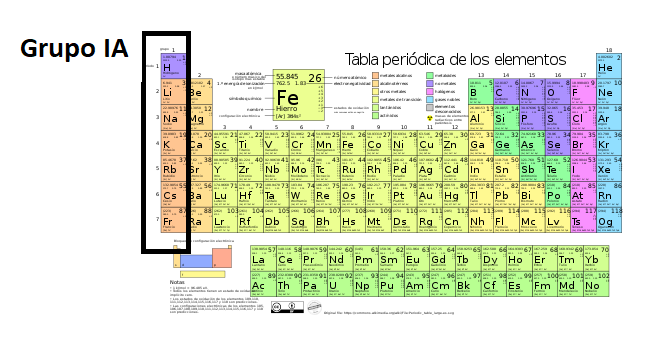
Grupo en la Tabla PeriódicaLos
grupos son las columnas de la tabla
periódica.
La tabla periódica tiene 18 grupos. Los elementos en cada grupo tienen propiedades químicas similares.
This is a modal window. No se ha podido cargar el vídeo debido a un fallo de red o del servidor o porque el formato es incompatible. |
I |
|---|
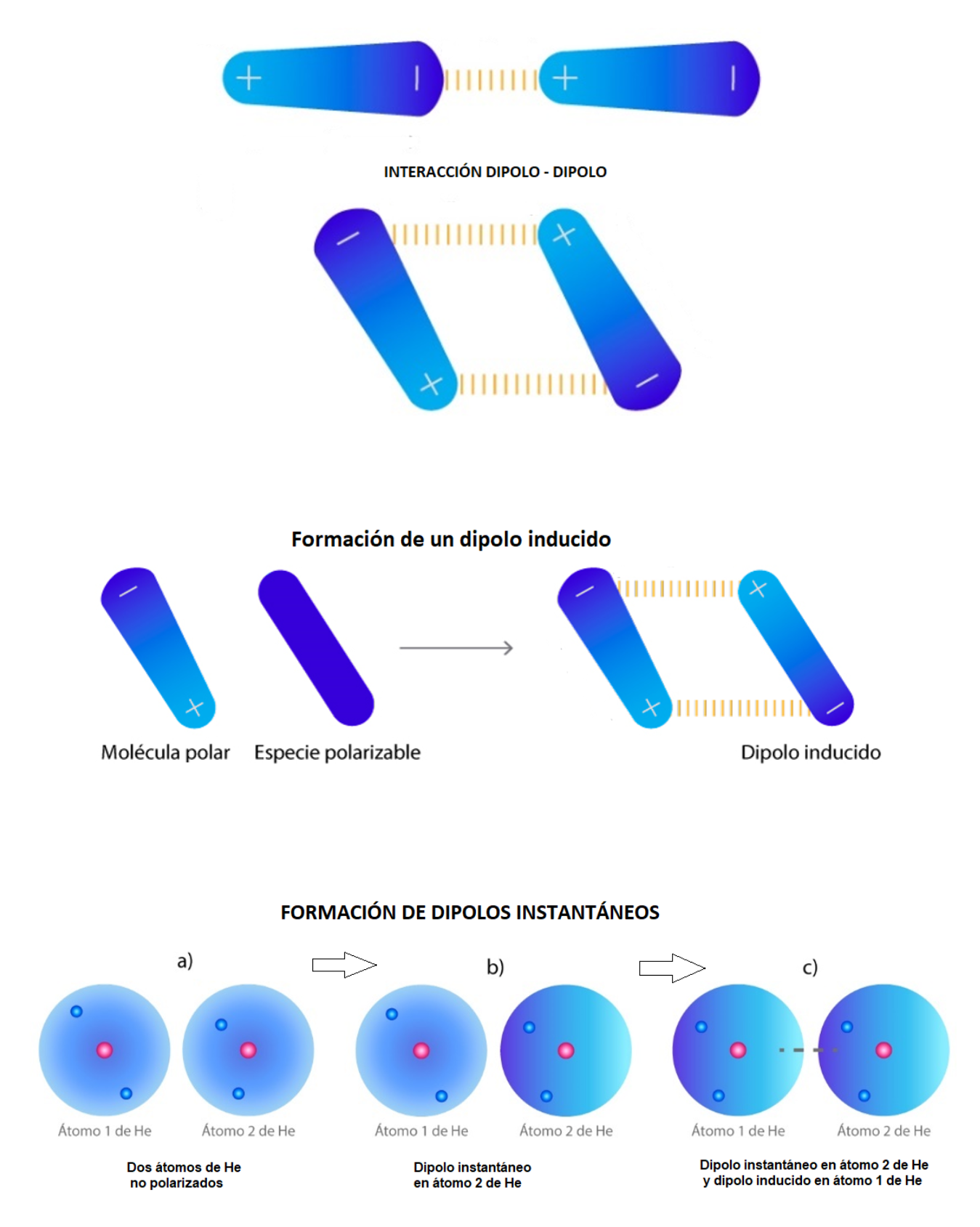
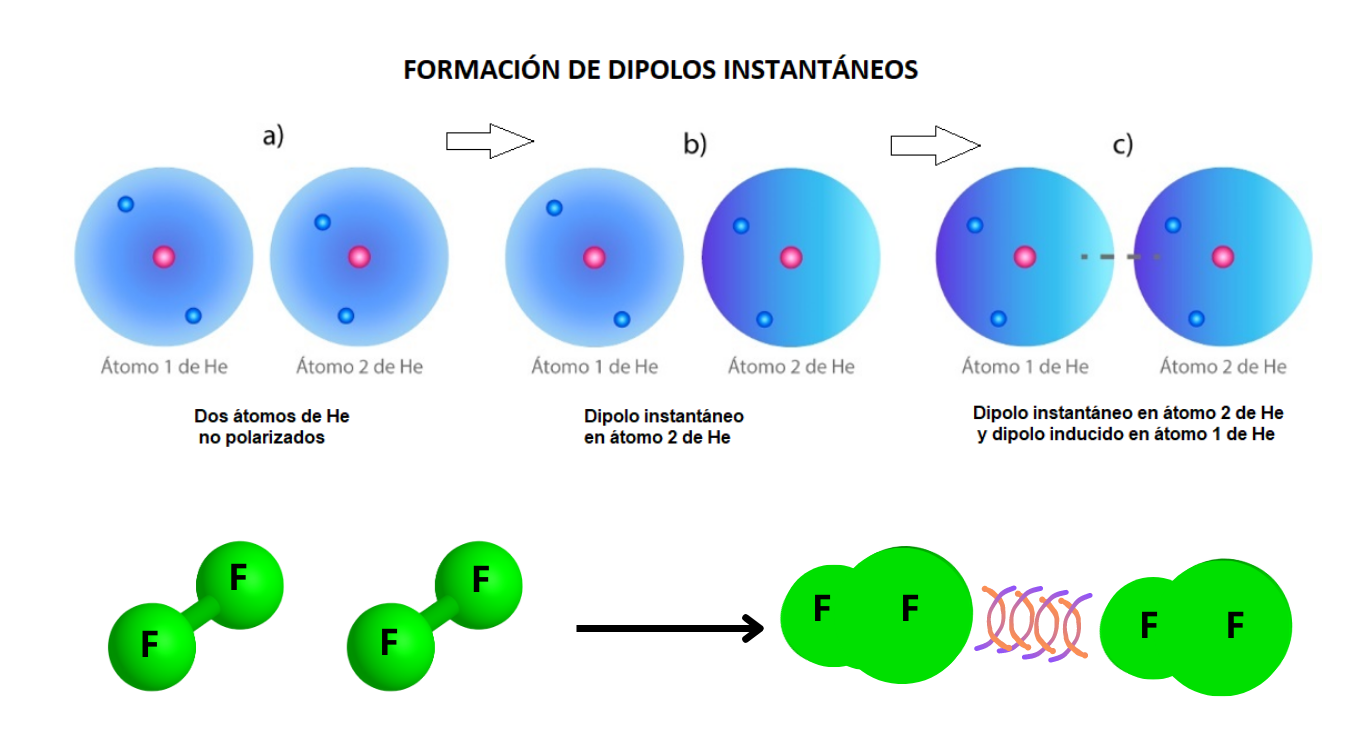
Interacción Dipolo Instantáneo - Dipolo Inducido (Fuerzas de London)La interacción dipolo instantáneo- dipolo inducido se establece cuando una molécula con un dipolo instantáneo genera un dipolo en otra molécula que está cerca (dipolo inducido). Un dipolo instantáneo se genera por cambios rápidos en la distribución de los electrones en la molécula. Los dipolos instantáneos generan atracciones entre las moléculas incluso cuando las moléculas no son polares.
This is a modal window. No se ha podido cargar el vídeo debido a un fallo de red o del servidor o porque el formato es incompatible. |
Interacción Dipolo - Dipolo (Fuerzas de Keesom)La interacción dipolo - dipolo se establece cuando una molécula polar (dipolo 1) se aproxima a otra molécula polar (dipolo 2). Esta interacción dipolo - dipolo mantiene unidas a las dos moléculas. La fuerza de la interacción dipolo - dipolo depende de:
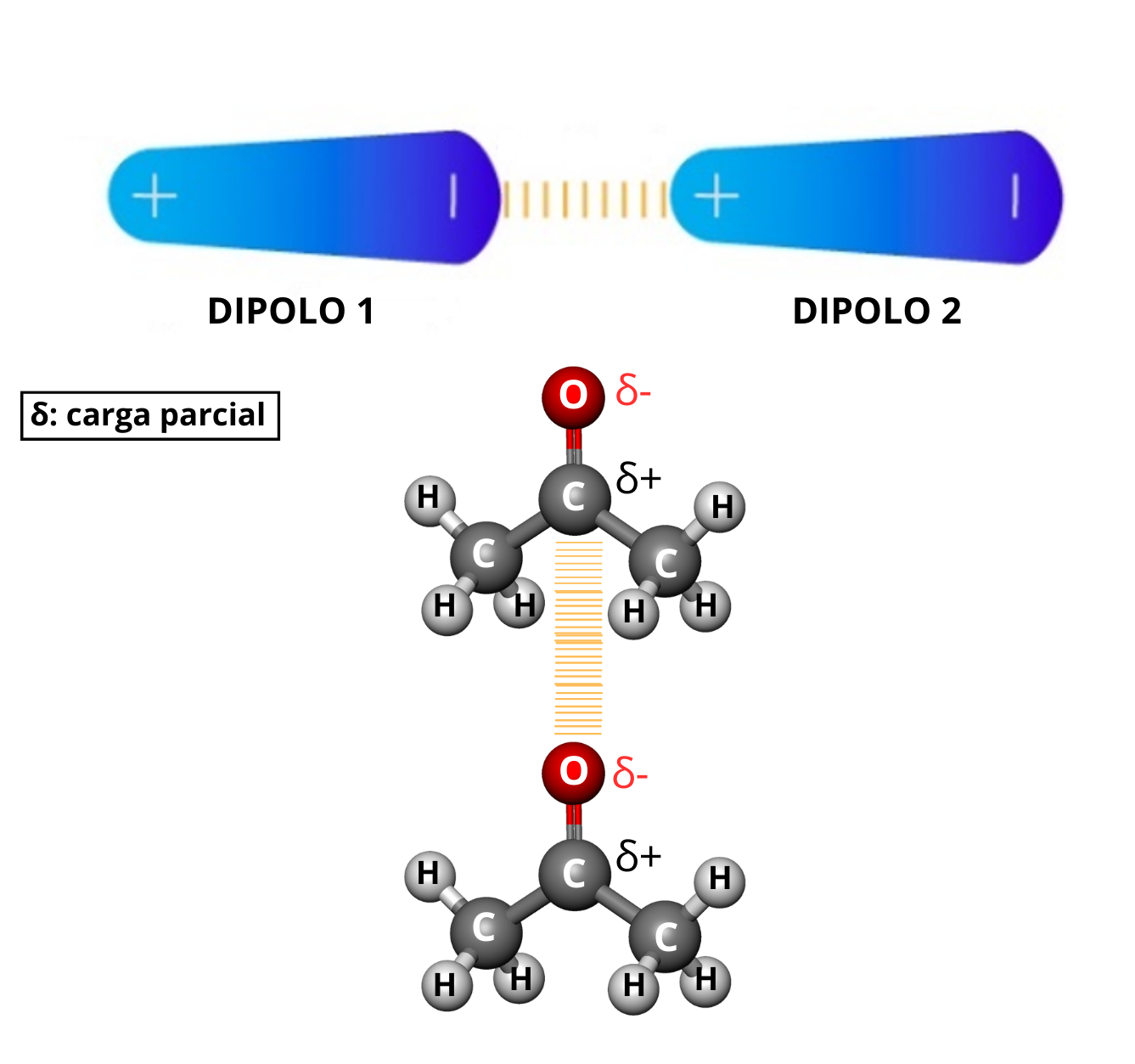 This is a modal window. No se ha podido cargar el vídeo debido a un fallo de red o del servidor o porque el formato es incompatible. |